
5.1. Конституционные защитные свойства
Первые исследователи пытались связать устойчивость растений с особенностями химического состава их тканей, исходя из того, что всё грибы, в том числе и фитопатогенные, являются хемотропически положительными, т. е. растут по направлению к питательным веществам. Была создана первая теория устойчивости, названная хемотропической. Согласно ей, если растение содержит вещества, диффундирующие через клеточную стенку и привлекающие паразитов, то оно поражаемо, если таких веществ нет - устойчиво. В дальнейшем эта теория широко обсуждалась, и одним из первых ее критиков был Н. И. Вавилов. Было показано, что споры грибов могут прорастать как через живой эпидермис, так и через полоску эпидермиса, клетки которого лишены содержимого. Кроме того, известно, что споры грибов одинаково прорастают через клеточную стенку как восприимчивых, так и устойчивых растений. А заразится или не заразится растение - зависит от процессов, развивающихся при взаимодействии продуктов патогена с плазмалеммой растения.
Дальнейшее изучение роли химического состава растений в устойчивости к патогенным микроорганизмам привело к возникновению еще двух теорий. Согласно одной из них (питательная теория или теория "неполной среды"), устойчивость растения обусловлена отсутствием в нем вещества (или веществ), необходимого паразиту. Эта теория была создана при работе с ауксотрофными мутантами, т. е. линиями грибов, неспособными самостоятельно синтезировать то или иное необходимое для их развития вещество. Такой мутант не может поразить растение, в тканях которого это вещество отсутствует, и это растение устойчиво. Если ввести искусственно такое вещество, то вирулентность патогена восстанавливается.
Очевидно, что эта теория приложима лишь для случаев взаимодействия растений с биотрофом, когда высокая степень специализации делает патоген зависимым от наличия питательных факторов хозяина. Что касается некротрофов, отличающихся широкой специализацией, то в данном случае известны лишь единичные случаи взаимоотношений растения и патогена, подчиняющиеся этой теории. В качестве примера можно привести случай, объясняющий устойчивость пшеницы к возбудителю фузариоза (Fusarium graminearum). Пшеница устойчива к этому паразиту до цветения, а в период цветения становится сильно восприимчивой. Оказывается, что заражение происходит через пыльники, в которых содержатся холин и бетаин - азотсодержащие метилированные спирты, входящие в состав фосфолипидов. Эти соединения усиливают инфекционность гриба, если добавить их к инокулюму. На инфекционность грибов, поражающих другие растения и не нуждающихся в этих веществах, они не влияют. Круг растений, поражаемых Fusarium graminearum, ограничен видами, содержащими холин в высокой концентрации.
Гораздо меньше данных получено о связи сортовой (специфической) устойчивости с неполной для паразита средой. Одной из первых работ в этом плане была работа К. Т. Сухорукова [10]. Он показал, что при заражении хлопчатника возбудителем вертициллезного вилта в тканях устойчивых сортов снижается содержание биотина, пантотеновой кислоты и общего "биоса". У поражаемых сортов содержание этих витаминов Повышается. Следовательно, устойчивые растения как бы устраняют физиологически активные вещества, необходимые патогену, из очагов поражения, и паразит в результате не находит в растениях благоприятной среды для роста.
В другой работе, подтверждающей питательную теорию, выявлена причина устойчивости риса к Xanthomonas oryzae. Эта бактерия не способна утилизировать неорганические источники серы и использует для своего развития серусодержащие аминокислоты. Экстрагированный из растений риса L-цистеин стимулирует рост Xanthomonas oryzae и повышает ее патогенность. Поэтому сорта риса, не содержащие L-цистеин или содержащие его в малых количествах, устойчивы к бактерии, и наоборот.
О применимости питательной теории для сортовой устойчивости свидетельствуют также работы Л. В. Метлицкого с сотрудниками [8]. Они подошли к исследованию этого вопроса с позиций индуцированной устойчивости: не только отсутствие необходимых паразиту соединений в интактной ткани может обусловливать устойчивость растений, но растение способно исключать из обмена в ответ на заражение вещества, необходимые паразиту. Так, возбудитель фитофтороза гриб Phytophthora infestans утратил в процессе сопряженной эволюции с хозяином способность синтезировать стерины и использует стерины растения-хозяина, которые необходимы ему для образования зооспор. В несовместимой комбинации (растение устойчиво) при заражении образуются некрозы, в которых накапливаются защитные антибиотические вещества - фитоалексины, а содержание стеринов резко снижается. Это происходит потому, что фитоалексины и стерины имеют общего предшественника в процессе синтеза, и если преимущественно синтезируются фитоалексины, то стерины не синтезируются (рис. 15), и растения лишают патогена необходимых ему соединений.
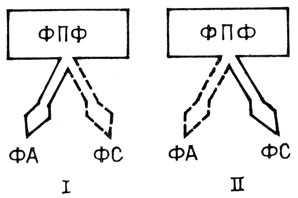
Рис. 15. Схема участия стеринов во взаимоотношениях картофеля и возбудителя фитофтороза (Phytophthora infestans): I - несовместимость (устойчивость); II - совместимость (поражаемость); ФПФ-фарнезилпирофосфат (предшественник), ФА-фитоалексины, ФС-фитостерины
Другая теория устойчивости, возникшая на основе изучения химического состава тканей растений, называется тормозящей гипотезой. Согласно этой теории, устойчивые растения зачастую содержат те или иные вещества, тормозящие развитие патогена.
Рассмотрим теперь, какие же компоненты тканей растений обладают защитными свойствами и подавляют рост паразита.
Углеводы. Различают 2 группы болезней, одна из которых связана с низким, а другая - с высоким содержанием в тканях сахаров. Например, обнаружено, что поражаемость ягод винограда и клещевины возбудителем серой гнили грибом Botrytis cinerea, а также ячменя возбудителем головни Ustilago hordei коррелирует с высокой сахаристостью тканей. Исследование механизма такой взаимосвязи между заболеваемостью и содержанием сахаров показало, что в этих случаях высокие концентрации сахара в тканях растений вызывают увеличение вирулентности патогенов. Так, при культивировании гриба Botrytis cinerea на средах с высоким содержанием сахаров (8% глюкозы или сахарозы) он образует большие количества винной и щавелевой кислот, являющихся токсином этого гриба. В случае же Ustilago hordei сахара положительно влияют на прорастание хламидоспор.
Другая группа болезней, напротив, связана с низким содержанием сахаров. Так, сорта овса, содержащие меньше гексоз, легче поражаются ржавчиной, хлопчатника - ризоктониозом, проса - гельминтоспориозом. В данном случае сахара снижают вирулентность паразитов. Например, гексозы подавляют прорастание спор ржавчины. Кроме того, многие сахара обладают способностью подавлять активность пектиназ и целлюлаз патогенов - основных факторов патогенности некротрофов - по типу катаболитной репрессии. Предположим, патоген имеет для питания среду, содержащую пектин и глюкозу. Естественно, что он предпочтет глюкозу, поскольку для использования пектина нужно образовывать ферменты, а для использования глюкозы они всегда имеются. Поэтому патоген начинает потреблять глюкозу вместо пектина, а пектиновые ферменты за ненадобностью перестает образовывать.
В случае наблюдающейся у некоторых растений возрастной устойчивости важная роль может принадлежать превращениям пектиновых веществ. Например, гипокотили фасоли устойчивы к возбудителю ризоктониоза Rhizoctonia solani в более молодом возрасте. Оказывается, что в молодых гипокотилях довольно активен фермент пектинэстераза, которая вызывает гидролитический распад сложноэфирной связи в молекуле растворимого пектина. При этом образуется метиловый спирт и полигалактуроновая кислота. Последняя сразу связывается с Ca2+, образуя пектаты, не поддающиеся растворению пектиназами патогена.
Белки. Устойчивость растений является генетическим, наследственным свойством. Можно ожидать, что непосредственные продукты генной активности - белки будут определять отношение растения к патогену.
Сравнительное изучение свойств белков здоровых растений, устойчивых и восприимчивых к заболеваниям, показало, что они различаются по ряду показателей. Так, выявлены различия в антигенном спектре между устойчивыми и восприимчивыми к фузариозу сортами льна, методом иммунохимии и хроматографии выделены белки, характерные только для устойчивых к ржавчине линий кукурузы. Сорта пшеницы, содержащие температурочувствительный ген Sr6, устойчивы к стеблевой ржавчине при температуре +20°С и восприимчивы при температуре +25°С. При этом устойчивость и восприимчивость коррелирует с определенными изменениями белкового профиля.
Роль белков в устойчивости картофеля к возбудителю рака Synchytrium endobioticum была подробно изучена Липсицем с сотрудниками [7]. Они обнаружили, что белки восприимчивых к возбудителю сортов картофеля по сравнению с устойчивыми содержат больше функциональных группировок (NH-2, COOH-, SH-, тирозин), легче денатурируют и атакуются протеазами. Нуклеопротеиды, выделенные из неустойчивых сортов, содержат меньше гистонов и нуклеиновых кислот по сравнению с устойчивыми. Все это делает молекулу белка неустойчивых растений реакционно-подвижной, в тканях, куда проник патоген, повышается метаболическая и ферментативная активность белков и усиливаются ростовые процессы, что является обязательной предпосылкой опухолеобразования.
Белки устойчивых сортов картофеля отличаются большей жесткостью глобулярной структуры, затрудняющей осуществление тех конформационных перестроек, которые необходимы для активации ростовых процессов.
Антивирусные белки. В соке многих здоровых растений (листья картофеля, красной гвоздики, турецкого табака и др.) содержатся белки, обладающие антивирусной активностью. Это так называемые конституционные белки. В некоторых случаях антивирусная активность сока растений коррелирует со степенью устойчивости сорта к вирусу.
Кроме того, антивирусные интерфероноподобные белки образуются в тканях устойчивых растений после их заражения вирусами. У сверхчувствительных растений, реагирующих на проникновение вируса образованием местных некрозов, вирус локализуется в пределах некротической зоны, а в околонекротической зоне образуются антивирусные белки, и эта зона устойчива к повторному заражению вирусом. Эти белки обладают рядом свойств, общих с интерфероном животных. Они легко диффундируют из зараженных клеток в незараженные и не обладают антивирусной специфичностью, т. е. они подавляют инфекционность вирусов, специфичных для растений различных семейств. Антивирусный фактор активен в отношении вирусов как при смешивании его с вытяжкой из зараженных вирусом растений, так и при введении в листья.
В тканях растений содержатся ферментные белки, которые оказывают лизирующее действие на гифы паразита. Основные компоненты клеточных стенок гиф грибов - полимеры хитин и β-1,3-глюкан. Растения содержат ферменты, разрушающие эти полимеры. К ним относятся хитиназа и β-1,3-глюканаза. Хотя растения не содержат субстратов этих ферментов, но в них находятся сами ферменты. Активность хитиназы и β-1,3-глюка пазы резко увеличивается при заражении. Параллельно увеличивается также содержание 2 видов мРНК, кодирующей эти ферменты, т. е. индукция ферментов происходит на уровне мРНК. При заражении гороха грибом Fusarium solani антигрибная защитная функция этих ферментов четче проявляется при их комбинации.
Исследование внутриклеточной локализации хитиназы и β-1,3-глюканазы показало, что обе локализованы в вакуоле. Считают, что эти формы энзимов используются растением как последняя линия обороны при атаке патогена. Кроме того, β-1,3-глюканаза содержится также в клеточной стенке. Следовательно, она может участвовать также в процессах распознавания паразита и высвобождении из клеточных стенок его мицелия индукторов, включающих защитные реакции растения.
Белки клеточной стенки. При исследовании большого набора двудольных растений было показано, что все они содержат связанные с их клеточными стенками белки, способные ингибировать действие эндонолигалактуроназы (ЭПГ) патогена - одного из факторов патогенности паразитических микроорганизмов. Эти белки-ингибиторы подавляют действие только ЭПГ, но не действуют на другие ферменты, разрушающие клеточные стенки. Обнаружено, что клеточные стенки содержат несколько различных ингибиторов ЭПГ, причем каждый из них ингибирует ЭПГ патогенов, неспецифичных для данного растения. При заражении содержание белковых ингибиторов в клеточных стенках увеличивается, при этом в одинаковой степени в совместимой и несовместимой комбинациях.
Было также установлено, что ЭПГ патогенов вызывает распад пектиновых соединений клеточной стенки растения с образованием олигогалактуронидов (ОГ), являющихся индукторами (элициторами) фитоалексинов - антимикробных веществ растений. Обнаружено, что элициторной активностью обладают ОГ со степенью полимеризации более 9. Фермент патогена деполимеризует полигалактуроновую кислоту пектина до элицитор-активных ОГ за 1 мин. Дальнейшая деполимеризация субстрата приводит к образованию ОГ, не обладающих элициторной активностью. Белки-ингибиторы клеточной стенки растения способны подавлять скорость деполимеризации субстратов с полигалактуроновой кислотой. Как было показано в модельных опытах, в присутствии белка- ингибитора количество элицитор-активных ОГ постоянно увеличивалось в течение 24 часов, и только через 48 часов под влиянием ЭПГ полигалактуроновая кислота превращалась в короткие элицитор-неактивные олигомеры.
Следовательно, белок клеточных стенок растения является рецептором для ЭПГ патогена. Образование комплекса "белок - ЭПГ" приводит к увеличению концентрации ОГ, которые активируют защитные реакции растения. Взаимодействие белка клеточной стенки растения с грибными ЭПГ является механизмом, посредством которого растение превращает фактор вирулентности патогена-ЭПГ в фактор, индуцирующий защитный механизм растения.
Обнаружено также, что ЭПГ гриба в присутствии избытка белка клеточной стенки сохраняет 0,3% своей активности. Этой остаточной активности вполне достаточно для образования элицитор-активных ОГ из полигалактуроновой кислоты пектина клеточной стенки, и в то же время она слишком мала для дальнейшей деполимеризации ОГ и превращения их в элицитор-неактивные соединения.
Среди белков, накапливающихся в клеточной стенке двудольных растений в ответ на внедрение патогенных микроорганизмов, высокой фунгицидной активностью обладают богатые гидроксипролином гликопротеины (ГОПГП). При заражении содержание этих соединений в клеточной стенке увеличивается и достигает 5 - 15%, в то время как клеточная стенка здоровых растений содержит 0,5% этих гликопротеинов. Такое обогащение клеточной стенки ГОПГП приводит к резким изменениям свойств клеточной стенки: усиливается прочность поверхности клетки, изменяется заряд ее стенки, обогащенная ГОПГП клеточная стенка обладает свойствами агглютинина по отношению к отрицательно заряженным патогенам. Наблюдения показывают, что накопление гликопротеинов, обогащенных гидроксипролином, в клеточной стенке арбуза повышает его устойчивость к грибу Colletotrichum lagenarium, подавление их синтеза приводило к увеличению поражаемости. Только обогащенный оксипролином гликопротеин проявляет защитные свойства. Содержание других белков клеточной стенки не коррелировало с устойчивостью.
Подобные закономерности обнаружены у различных растений семейства двудольных при заражении грибами, бактериями, вирусами. Синтез ГОПГП может быть индуцирован in vitro элициторами грибов, а также эндогенными индукторами растений.
Ингибиторы ферментов патогенов обнаружены также и в клеточном содержимом. Так, многие растения, в частности листья, корни и зерно пшеницы и других злаков, а также семена бобовых, сложноцветных (подсолнечник), клубни картофеля, топинамбура содержат комплекс белков, подавляющих активность разнообразных гидролаз патогенных микроорганизмов. Среди них - ингибиторы протеиназ и а-амилазы. Особенно широко распространены и наиболее изучены ингибиторы трипсиноподобных протеиназ грибов. Для большинства типов ингибиторов не найдены эндогенные гидролазы - "мишени". Высокая специфичность к экзогенным ферментам указывает на возможную защитную роль данных белков.
Так, в эндосперме диплоидных пшениц, а также Triticum timophaeevii, которые обладают в целом иммунитетом ко многим болезням, обнаружен особый тип ингибиторов трипсинонодобных протеиназ с высокой активностью. Возможно, что этот ингибитор - один из факторов повышенной устойчивости данных видов. Обнаружена также достаточно высокая и достоверная положительная связь между устойчивостью полиплоидных пшениц к твердой головне и активностью ингибитора трипсина. Активность ингибиторов протеиназ гриба Botrytis cinerea в семенах невосприимчивых сортов и форм подсолнечника выше в 4 - 9 раз, чем у восприимчивых.
Было обнаружено, что элициторы патогенов могут индуцировать накопление протеиназных ингибиторов в тканях растений. Так, элициторы гриба Phytophthora parasitica var. nicotianae индуцировали образование ингибиторов протеиназ в суспензионной культуре клеток табака.
Выявлен и другой механизм инактивации патогенов белками семян растений. Так, в семенах ячменя содержится белок с М.в. 30 000 Д, который вызывает инактивацию рибосом гриба Trichoderma reesei.
Лектины - это белки или гликоиротеины, которые селективно агглютинируют определенные типы клеток. Их специфичность обусловлена комплементарностью но отношению к определенным группировкам углеводов. Способность лектинов "распознавать" определенные углеводные группировки и типы клеток наводила на мысль, что они могут участвовать в процессах специфического взаимодействия растения и патогена. Дальнейшая разработка этих вопросов позволила получить конкретные доказательства роли лектинов во взаимодействии растения и паразита.
1. Прежде всего было показано, что лектины могут взаимодействовать с мицелием патогенов, а также оказывать агглютинирующее действие на споры. Так, лектин из зародыша пшеницы специфичен по отношению к хитиновому олигомеру β-(1,4)-N-ацетил-Д-глюкозамину. Он может связываться с верхушкой гифы и септами гриба Trichoderma viridae, подавляет рост и прорастание спор гриба и препятствует синтезу хитина. Аналогичное действие оказывает лектин из зародышей пшеницы на грибы видов хитинсодержащих грибов из родов Zigo-, Asco-, Basidio- и Deuterornycetes. Лектин соевых бобов, распознающий Д-галактозу и N-ацетил-Д-галактозамин, а также лектин арахиса, специфичный к Д-галактозе, связывают молодые споры и участки зрелого мицелия гиф видов Penicillium и Aspergillus. Лектин батата, являющийся гликопротеином, агглютинирует споры гриба Ceratocystis fimbriata, не являющегося патогеном батата. Споры вирулентных штаммов гриба лектином не агглютинируются.
2. Предполагают, что лектины могут защищать растения от грибов при набухании семян, прорастании и ранних этапах роста проростков. Так, при прорастании семян Datura stramonium из них выделяются лектины, которые значительно снижают подвижность и миграцию почвенных бактерий. Лектины, выделяющиеся в почву при прорастании семян сои, устойчивы к почвенным протеазам, т. к. взаимодействуют с гуминовыми кислотами почвы. Находясь в почве около корней, освободившийся из семян лектин может защищать растения от патогенных грибов и бактерий, распознавая и связывая их.
3. Лектины участвуют также в распознавании сапрофитных, авирулентных штаммов бактерий, иммобилизуя их в местах проникновения в клетки растения. Такие агглютинированные клетки бактерий обнаруживаются либо в элементах проводящих путей, либо прикрепленными к поверхности клетки растения. Патогенные бактерии не агглютинируются в ткани и свободно размножаются в межклеточном пространстве. В связывании авирулентных бактерий участвуют лектин плазмалеммы и липополисахаридный комплекс бактерии. Имеется много примеров, подтверждающих эти данные. Лектин картофеля, обогащенный оксипролином, селективно агрегирует авирулентный штамм Pseudomonas solanacearum. При введении в ткани растения табака авирулентной бактерии Pseudomonas pisi лектиноподобный белок паренхимы ксилемы агглютинирует бактерию, присоединяясь к ее оболочке. Бактерия образует сгустки и лизирует. При введении в стебель яблони авирулентной к ней бактерии Erwinia amylovora патоген агглютинирует в ксилеме стебля. Агглютинирующий фактор, как было установлено, является белком, агглютинирующая и преципитирующая активности которого сосредоточены в части положительно заряженной молекулы. Предполагается, что агглютинация клеток бактерии происходит путем электростатического взаимодействия с отрицательно заряженными компонентами на поверхности бактериальной клетки.
4. Лектины, содержащиеся в плазмалемме, обладают способностью связываться с токсинами патогена. Первый изученный мембранный белок выделен из плазмалеммы сахарного тростника, и установлена его роль в поражаемости тростника грибом Helminthosporinm sacchari. Гриб, а также его токсин, названный гельминтоспорозидом, вызывает увеличение проницаемости тканей. Был получен 14C-токсин, являющийся галактозидом, и обнаружено, что он связывается с белком мембраны неустойчивого сорта, но не связывается с белком мембраны устойчивого сорта. При экстракции мембран тростника детергентом тритоном Х-100 из обоих сортов выделен белок, являющийся олигомером с М.В.49 000Д, содержащий 4 субъединицы и 2 участка связывания токсина. Однако мембранные белки устойчивого и восприимчивого сортов отличались по электрофоретической подвижности и 4 аминокислотам. Очевидно, эти структурные отличия и лежат в основе различной токсинсвязывающей активности лектинов устойчивого и восприимчивого сортов сахарного тростника: белки плазмалеммы восприимчивого сорта связывают токсин патогена, и это приводит к поражению растения, у устойчивого они такой способностью не обладают. Связываясь с плазмалеммой, токсин вызывает нарушение конформации структуры мембраны, в том числе и мембранносвязанной транспортной АТФазы. Это приводит к активации фермента и увеличению вымываемости содержимого клеток. В результате нарушается ионный баланс в клетке, и наступает ее гибель.
Токсин гриба Fusicoccum amygdalii - возбудителя рака миндаля и персика - фузикокцин также связывается с рецептором на мембране растения, представляющим собой белок с М.В.80 000Д. Токсин вызывает увеличение проницаемости мембран растений, активирует катионстимулируемую АТФазу.
Следовательно, на мембране есть белковые рецепторы токсинов. У восприимчивых растений они специфически связывают токсин, у устойчивых рецепторы отсутствуют или снижено их сродство к токсину.
Органические кислоты. В свое время были популярны взгляды, что ткани растений, содержащие повышенное количество кислот, более устойчивы к патогенным микроорганизмам. Анализ большого фактического материала позволил заключить, что зависимость устойчивости растительных тканей от их кислотности не может рассматриваться как общая закономерность, а является скорее частным случаем. Иногда наблюдается кажущаяся корреляция между кислотностью клеточного сока и устойчивостью растения к заболеванию. Например, молодые зеленые плоды томатов поражаются фузариозом, а зрелые устойчивы к заболеванию. Поскольку зрелые томаты содержат больше органических кислот, их устойчивость к патогену связывали с кислотностью содержимого клеток. Однако в дальнейшем было установлено, что при созревании плодов томатов увеличивается их механическая прочность, и это является причиной устойчивости. Возражением против этой теории является тот факт, что ткани растений более чувствительны к высоким концентрациям кислот, чем ткани грибов. Последние отличаются высокой пластичностью и адаптивной способностью. Например, обнаружено, что споры гриба Gloesporum perennans прорастают на яблочной кислоте, имеющей pH 2,4.
Кислотность клеточного содержимого может играть роль в устойчивости растительных тканей к бактериальным заболеваниям, поскольку бактерии весьма чувствительны к понижению pH. Так, возбудитель бактериальной пятнистости томатов бактерия Xanthomonas vesicatoria не может развиваться при pH ниже 5. Поэтому спелые плоды томатов, pH клеточного сока которых 4,0 - 4,6, не заражаются бактерией, в то время как зеленые плоды, имеющие pH выше 5, подвержены заболеванию.
Физиологически активные вещества. Поскольку многие фитопатогенные микроорганизмы являются гетеротрофами в отношении ряда витаминов, были попытки связать устойчивость растений к патогенам с содержанием в тканях этих соединений. В частности, К. Т. Сухоруков изучал роль "биоса" (сумма m-инозита, близких по строению α- и β-биотинов неидентифицированного компонента) в устойчивости ряда сортов моркови и арбуза к заболеваниям и обнаружил, что чем богаче растение "биосом", тем сильнее оно поражается, и наоборот. Выше приводились исследования этого автора, в которых было показано, что при заражении устойчивых сортов хлопчатника возбудителем вертициллезного вилта в них уменьшается содержание биотина, пантотеновой кислоты и общего "биоса", что и тормозит развитие патогена [10]. Однако имеются исследования, в которых получены прямо противоположные закономерности. Так, в белокочанной капусте также обнаружен "биос", а сорта капусты, неустойчивые к серой гнили, обладают большим биотическим действием, чем устойчивые. После хранения капусты в атмосфере CO2 в ней резко падает содержание "биоса", однако ее устойчивость при этом не возрастает, как можно было ожидать, исходя из наблюдений К. Т. Сухорукова, а, напротив, снижается.
Следовательно, эти данные нельзя рассматривать как общую закономерность.
Есть наблюдения, показывающие, что некоторые витамины способны повышать или, напротив, понижать токсичность фузариновой кислоты - токсина гриба возбудителя вилта хлопчатника Fusarium oxysporum vasinfectum. Так, если в тканях растения-хозяина содержится больше тиамина (витамина B1), то их устойчивость к фузариозному увяданию снижается, если никотиновой кислоты - увеличивается. Оказывается, что тиамин входит в состав фермента - декарбоксилазы фузариновой кислоты. При декарбоксилировании токсина он превращается в 3п-бутилпиридин - соединение, которое гораздо токсичнее фузариновой кислоты. Напротив, никотиновая кислота нейтрализует действие фузариновой кислоты за счет структурного сходства их молекул (рис. 16).
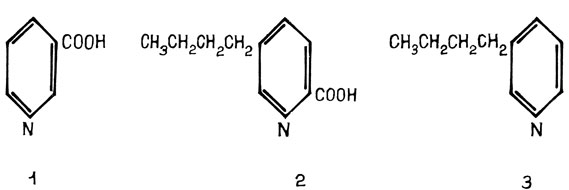
Рис. 16. Формулы никотиновой (1), фузариновой (2) кислот и 3п-бутилпиридина (3)
Фитонциды. Это соединения, продуцируемые растением, обладающие фунгицидным, бактерицидным и протистоцидным действием и являющиеся факторами иммунитета растений. Они играют важную роль во взаимоотношениях организмов в биоценозах. Роль фитонцидов в явлениях фитоиммунитета активно изучалась у нас в стране Д. Д. Вердеревским с сотрудниками. Они пришли к выводу, что фитонциды играют ведущую роль в неспецифической устойчивости растений и предохраняют их от комплекса окружающих микроорганизмов. Как считал Д. Д. Вердеревский, фитонциды в тканях растений играют столь же важную и универсальную роль, как фагоцитоз у животных. Специализированные же паразиты теми или иными способами адаптируются к фитонцидам растения-хозяина [4]. Фитонцидной активностью обладают интактные растительные ткани, поврежденные механически, а также инфицированные. В пораненных и инфицированных тканях фитонцидная активность сильно возрастает.
По химическому составу фитонциды представляют собой комплекс соединений. Среди них наиболее изученными являются: 1) терпеноиды, 2) глюкозиды, 3) пигменты, 4) эфирные масла, 5) алкалоиды, 6) фенольные соединения.
Терпеноиды содержатся в смоле древесных (особенно хвойных) пород. Многие из них подавляют рост грибов in vitro и играют защитную роль в природе. Особенно велика их роль в защите древесины от древоразрушающих грибов. Например, монотерпены защищают хвойные породы от заражения возбудителем пузырчатой ржавчины, сесквитерпеновые ортохиноны-ильмовые - от заражения Ceratocystis ulmi.
Глюкозиды. Эти соединения сами по себе не обладают токсичностью по отношению к патогенам. Токсичны продукты их распада - аглюконы. В клетке растения глюкозиды содержатся в вакуоле, а ферменты, вызывающие их распад - р-глюкозидазы, - в цитоплазме. При повреждении клетки (в том числе после проникновения патогена) нарушается проницаемость мембраны вакуоли (тонопласта), глюкозиды поступают ускоренно в цитоплазму, где происходит их расщепление под влиянием р-глюкозидазы с образованием высокотоксичных аглюконов.
В зависимости от типа аглюкона различают терпеновые глюкозиды (сапонины), цианогенные глюкозиды, тиоглюкозиды, фенольные глюкозиды и т. д.
Терпеновые глюкозиды, активную часть которых составляют сапогенины, обладают мембраноактивным действием. Они связываются со стеринами мембраны и вызывают изменение ее жесткости и проницаемости.
Цианогенные глюкозиды имеют в качестве аглюкона цианид. Примером такого глюкозида является линамарин - глюкозид льна. Цианиды, как известно, представляют собой мощные ферментные яды.
Тиоглюкозиды содержатся в тканях семейства крестоцветных (капуста, горчица). Представителем этой группы глюкозидов являются горчичные масла, содержащиеся в вакуоли. Под влиянием цитоплазматического фермента - мирозиназы от них отщепляются летучие остро пахнущие высокотоксичные соединения, содержащие изородановую группу R-N=C=S-.
Некоторые исследователи пытались связать устойчивость капусты к возбудителю килы (биотроф) с образованием этих соединений. Однако было установлено, что возбудитель килы, как и другие биотрофы, не повреждает мембраны растения-хозяина. В настоящее время общепризнанно, что глюкозиды крестоцветных играют важную роль в защите корней растений от почвенной сапрофитной микрофлоры.
Фенольные глюкозиды содержат в качестве аглюкона фенолы. Например, аглюкон глюкозида груши арбутина - гидрохинон, глюкозида лука кверцетина - о-катехол и т. д. Защитные функции фенольных соединений, в том числе и фенольных аглюконов, будут рассмотрены в разделе "Индуцированные защитные свойства".
Итак, глюкозиды защищают клетку в результате быстрого накопления в ней при повреждении токсического начала - аглюкона. Такая система защиты эффективна против некротрофов, вызывающих повреждение зараженных клеток. Биотрофы же оказывают мягкое воздействие на клетку хозяина (по крайней мере на первых этапах взаимодействия) и не вызывают образования токсических продуктов гидролиза глюкозидов.
Пигменты (антоцианы). Замечено, что окрашенные органы растений устойчивы к болезням. Это объясняется тем, что, как и в случае с глюкозидами, при повреждении тканей патогеном наблюдается процесс распада антоцианов с образованием токсичного для микроорганизмов антоцианидина.
Эфирные масла. Защитные свойства этой группы соединений также обнаруживаются в процессе их превращений. Например, в тканях лука содержатся эфирные масла, основной компонент которых - аллиин. В состоянии покоя луковицы подвержены гниению, вызываемому грибом Botrytis allii. Однако при выходе из состояния покоя устойчивость лука к этому патогену возрастает. Оказалось, что в это же самое время активируется фермент аллииназа, под влиянием которого аллиин превращается в аллицин - соединение, обладающее фунгицидными свойствами.
Алкалоиды. Поскольку эта группа соединений токсична не только для грибов, но в еще большей степени для тканей растений, они не могут накапливаться в высоких концентрациях во всех тканях. Известны случаи, когда алкалоиды содержатся в больших количествах в отдельных тканях или даже группах клеток, предохраняя их от заражения. Например, в корнях Mahonia trifoliata, устойчивой к грибу Phymatotrichum omnivorum, имеются отдельные клетки паренхимы, содержащие алкалоид берберин в концентрации почти в 70 раз выше той, которая полностью приостанавливает развитие Phymatotrichum omnivorum при культуре на питательной среде. В то же время жизнедеятельные клетки и клетки сердцевинных лучей не содержат заметных количеств этого алкалоида.
Алкалоидам отводится важная защитная роль в борьбе растений с т. н. раневыми патогенами. Например, в раневой перидерме, которая образуется в местах повреждений клубней картофеля, накапливаются значительные количества а-соланина и а-чаконина, которые, наряду с другими содержащимися в раневой перидерме соединениями, защищают клубень от раневого паразита Fusarium solani.
Фенолы. Среди присутствующих в клетках растений веществ, токсичных для микроорганизмов, большое внимание уделяется фенольным соединениям. Подобный интерес к этой группе веществ объясняется тем, что еще в 1911 - 1915 гг. была обнаружена токсичность некоторых производных фенолов для большого числа фитопатогенных микроорганизмов в чистой культуре. В дальнейшем была обнаружена взаимосвязь между устойчивостью мертвых тканей и содержащимися в них фенольными соединениями. В качестве примера можно привести ставшей уже классической работу с окрашенными луковицами. Эти луковицы, имеющие сухие окрашенные чешуи, устойчивы к грибу Botrytis allii. При выяснении причин их непоражаемости обнаружили, что в инфекционную каплю, находящуюся на поверхности чешуи, диффундируют фенолы, которые и ингибируют паразита. Если удалить сухие чешуи, луковица заболевает.
Однако при поиске корреляций между содержанием фенолов в живых тканях и их устойчивостью к заболеванию были получены противоречивые результаты. В одних случаях такие корреляции обнаруживались, в других - нет. Исследование этих противоречий показало, что необходимо учитывать не только количественное содержание фенольных соединений в пораженных тканях, но и качественный их состав. Дело в том, что наибольшей токсичностью по отношению к патогенам обладают фенолы, которые легко окисляются, а способность к окислению определяется строением их молекулы. Наибольшей способностью к окислению обладают фенолы, у которых гидроксильные группировки находятся в пара- и ортоположении (рис. 17). В то же время фенолы с мета-положением гидроксилов окисляются значительно медленнее.
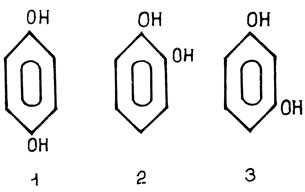
Рис. 17. Фенолы с пара(1)-, орто(2)- и мета (3) - расположением гидроксилов
В многочисленных исследованиях показано, что в инфицированных тканях происходит накопление фенольных соединений. Это достигается прежде всего за счет процесса синтеза de novo. Об этом свидетельствуют опыты с мечеными предшественниками, а также активирование ферментных систем, участвующих в процессах биосинтеза фенолов, таких как фенилаланинаммоний лиазы, пероксидазы, полифенолоксидазы. Кроме того, под влиянием патогена активируется апотомический (гексозомоно-фосфатный) путь окисления глюкозы, промежуточным Продуктом которого является эритрозо-4-фосфат - предшественник ароматического кольца. Наконец, как уже отмечалось выше, в инфицированных тканях наблюдается гидролиз глюкозидов, аглюконом которых могут быть фенольные соединения.
Накапливающиеся в зараженных тканях растений фенолы могут выполнять в них различные защитные функции.
Поскольку фенолы являются факторами роста, их соотношение в тканях оказывает влияние на ростовые процессы в клетке, а следовательно, и на развитие патогена. Известно также, что фенолы участвуют в процессах синтеза лигнина. Например, коричная кислота в процессе окислительной полимеризации образует лигнин, являющийся фактором механической прочности ткани. Связываясь с полисахаридами клеточных стенок, лигнин экранирует их от атаки ферментов паразита. Большинство патогенов не способно осуществлять деградацию лигнина. Кроме того, лигнин может откладываться на поверхности гиф патогенов и тормозить их рост. Наконец, лигнин ограничивает диффузию токсинов паразита в клетку и питательных веществ из клетки в гифу.
Важную роль в защитных реакциях растения на внедрение патогенных микроорганизмов играют также окислительные превращения фенолов, которым они подвергаются в инфицированной клетке.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'