
Ядро, рибосомы и синтез белка
За несколько последних десятилетий биологам удалось составить себе довольно полное представление о структуре, химизме и функциях важнейших клеточных органелл. Самая крупная органелла клетки - ядро (см. рис. 2.3). Это сферическое тело диаметром 5-10 мкм содержит большую часть генетической информации клетки, закодированной в виде длинных нитей сложного химического соединения - дезоксирибонуклеиновой кислоты (ДНК). ДНК присутствует в клетке в составе хроматина - сложного вещества, состоящего в основном из отрицательно заряженной ДНК и положительно заряженных белков, принадлежащих к классу гистонов. В неделящейся клетке хроматин образует рыхлую сеть. К началу деления выявляется истинная природа этой "сети" - хроматин конденсируется и образует дискретные, легко идентифицируемые палочковидные тельца, названные хромосомами, число которых для клеток каждого вида постоянно. В любой клетке растения гороха имеется, например, 14 хромосом - по 7 от каждого из родителей. У человека число хромосом в клетке равно 46, по 23 от матери и от отца. Такое клеточное деление, при котором число хромосом удваивается, так что каждая дочерняя клетка получает двойной набор хромосом, носит название митоза (см. ниже).
Полный двойной набор хромосом называют диплоидным (2 п), а набор, получаемый от каждого из родителей через половые клетки, - гаплоидным (п). Все клетки высшего растения, за исключением гаплоидных половых, как минимум диплоидны. Гаплоидные половые клетки находятся преимущественно в зрелых пыльцевых зернах и в зародышевом мешке семязачатка. В жизненном цикле растения гаплоидный набор получается из диплоидного в результате редукционного деления, или мейоза (см. стр. 34), протекающего в материнских клетках микро- и мегаспор, находящихся соответственно в пыльниках и семязачатке цветка. Возникшие таким путем гаплоидные клетки делятся и дают начало мужским и женским гаметофитам, в которых в конце концов и образуются половые клетки, или гаме- ты, т. е. спермии и яйцеклетки. Когда - при половом размножении- женские и мужские гаметы сливаются в зиготу, происходит восстановление диплоидного числа хромосом, свойственного спорофиту. Прослеживая изменения в числе хромосом и в содержании ДНК, мы видим, что в цветковом растении совершается цикл, в котором диплоидия сменяется гаплоидией, а последующее слияние гаплоидных клеток разного генетического происхождения в новый диплоидный организм порождает новые комбинации генетических признаков.
Митоз
В клетке перед видимым проявлением митотической активности количество хромосомной ДНК удваивается. Митоз начинается, когда хромосомы уже удвоились и видно, что каждая из них состоит из двух рядом лежащих нитей, или двух половинок, так называемых хроматид. Ядрышко и ядерная мембрана исчезают, хромосомы выстраиваются в экваториальной плоскости клетки, и нити веретена, соединяющие экваториальную пластинку с полюсами клетки, растаскивают к противоположным полюсам сестринские хроматиды, которые превращаются теперь в две отдельные, но вполне идентичные хромосомы. Реконструируются типичные интерфазные ядра, в каждом из которых восстанавливается мембрана, ядрышко и сеть хроматина. Вскоре, после того как одно ядро разделилось на два, наступает завершающая стадия клеточного деления - формирование клеточной пластинки, разделяющей клетку пополам в экваториальной плоскости (цитокинез). Собственно митоз длится 1-2 ч, на синтез же ДНК и прочие подготовительные реакции, необходимые для следующего клеточного деления, уходит еще около 6 ч (рис. 2.9).
Мейоз
Мейоз отличается от митоза тем, что уже удвоившиеся гомологичные хромосомы сближаются и располагаются рядом, тесно примыкая друг к другу по всей своей длине (синапсис). В этот период четыре прижатые одна к другой хроматиды могут перепутываться и обмениваться отдельными участками (кроссинговер); в любой данной точке претерпевать кроссинговер могут только две хроматиды. Пары хромосом выстраиваются в экваториальной пластинке, гомологичные хромосомы, подобно сестринским хроматидам при митозе, расходятся к противоположным полюсам и в конечном итоге оказываются в двух разных клетках. В каждой из этих дочерних клеток происходит затем второе деление мейоза (по сути, митоз в клетке с гаплоидным числом хромосом), при котором к противоположным полюсам расходятся сестринские хроматиды. В результате двух мейотических делений образуются четыре клетки, каждая с уменьшенным вдвое (гаплоидным) числом хромосом, а возможно (благодаря кроссинговеру), и с какими-то новыми, отличными от родительских типами хромосом (см. рис. 2.9).

Рис. 2.9. Митоз и мейоз в клетке
До недавнего времени считалось, что в растительном организме все соматические клетки диплоидны. Теперь, однако, мы знаем, что в растениях встречаются отдельные скопления клеток с числом хромосом, кратным диплоидному: 4п, 6п, 8п и т. д. Такие полиплоидные клетки возникают, очевидно, в результате делений ядра, не сопровождающихся расхождением дочерних ядер по двум отдельным клеткам. Плоидность клеток удается иногда регулировать с помощью тех или иных природных или синтетических веществ. Полиплоидию, например, можно вызвать колхицином - алкалоидом из клубнелуковиц (укороченных мясистых стеблей) безвременника осеннего. Колхицин препятствует образованию нитей веретена и тем самым предотвращает расхождение двух наборов хромосом к противоположным полюсам делящейся клетки. Иногда возникают анеуплоиды. Это происходит в результате случайной утраты или, напротив, приобретения одной или нескольких хромосом. Такие экземпляры (2n+1 или 2n-1) обычно в той или иной степени аномальны, но они могут быть и жизнеспособными.
Молекулы ДНК в хромосомах представляют собой линейные полимеры, построенные из четырех типов нуклеотидов. Порядок расположения нуклеотидов в цепи ДНК определяет генетическую информацию, которую несет эта цепь. Наследственность у растения зависит, таким образом, по существу от расположения нуклеотидов в молекулах ДНК, находящихся в хромосомах ядра и в некоторых других клеточных органеллах, а именно в хлоропластах и митохондриях. Одну из самых увлекательных глав современной биохимии составляет история открытия механизма, посредством которого информация, заключенная в молекулах ДНК, транскрибируется с образованием родственного ДНК соединения - РНК (рибонуклеиновой кислоты), а затем информация РНК в свою очередь транслируется и таким путем определяет природу вновь синтезируемых белков. Поскольку этот процесс имеет решающее значение для клеточной структуры и функции, мы здесь опишем его довольно подробно, хотя многое в этой области стало уже общеизвестным даже среди неспециалистов.
На протяжении большей части жизни клетки ядро отделено от цитоплазмы ядерной оболочкой, представляющей собой двойную мембрану с многочисленными крупными порами и длинными выростами, проникающими глубоко в цитоплазму (см. рис. 2.3). Выросты часто непосредственно переходят в эндоплазматический ретикулум (ЭР) - сильно разветвленную мембранную сеть, пронизывающую всю цитоплазму. Рибосомы - сферические частицы диаметром около 0,2 мкм, состоящие в основном из высокомолекулярной РНК и белка, - могут быть прикреплены к мембранам эндоплазматического ретикулума, но могут также лежать в цитоплазме свободно. Прикрепленные к ЭР рибосомы входят в состав шероховатого эндоплазматического ретикулума; по всей вероятности, они участвуют в синтезе того белка, который выделяется в просвет ЭР, т. е. в замкнутое пространство между его мембранами. Что касается рибосом, находящихся в цитоплазме, то они иногда группами присоединяются к информационной (матричной) РНК и тогда видно, что они располагаются вдоль этой длинной нити. Такие скопления рибосом называют полирибосомами: подобно рибосомам ЭР, они участвуют в синтезе белка до тех пор, пока сохраняют контакт с матричной РНК. Белки - крупные молекулы, построенные из расположенных в определенном порядке аминокислот, - синтезируются на поверхности рибосом. Сложный механизм этого синтеза включает транскрипцию, т. е. перевод содержащейся в ДНК информации в РНК, и затем трансляцию - перевод информации, закодированной в последовательности, нуклеотидных остатков РНК в последовательность аминокислотных остатков синтезируемого белка. Поскольку работу всей биохимической фабрики клетки регулируют активные белковые молекулы - ферменты, ключ к клеточной регуляции следует искать в том, что специфичность белков в конечном счете определяется ДНК.
Нуклеиновые кислоты и синтез белка
ДНК существует в виде двух нитей, или цепей, закрученных в двойную спираль (рис. 2.10). Каждая цепь представляет собой линейный полимер, построенный из нуклеотидов четырех типов. В состав каждого нуклеотида входят одно азотистое основание (аденин, гуанин, цитозин или тимин), сахар (дезоксирибоза) и остаток фосфорной кислоты. Участок молекулы ДНК, кодирующий полную аминокислотную последовательность какого-нибудь белка, называется геном. Порядок расположения нуклеотидов в той или иной цепи ДНК определяет ту генетическую информацию, которую несет данная молекула (подобно тому как буквы в каком-нибудь слове определяют его смысл). Если обозначить нуклеотиды (по соответствующим азотистым основаниям) как A, G, C и T, то сказанное будет означать, что последовательности -ACGT-, AGCT- и ATCG- содержат разную генетическую информацию.
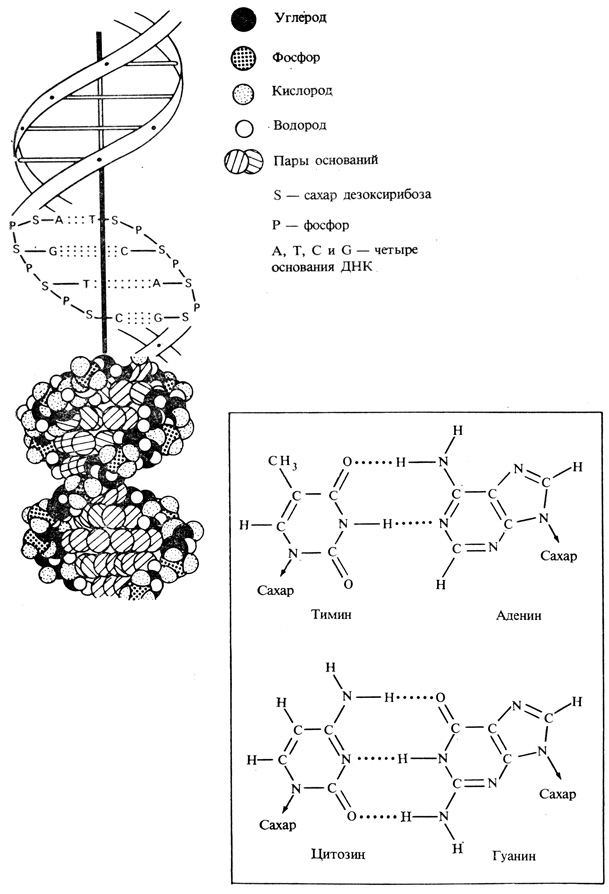
Рис. 2.10. Объемная и плоскостная схемы строения двойной спирали ДНК. (Swanson C. P. 1964. The Cell, 2nd ed., Englewood Cliffs, N. J., Prentice-Hall.) Буквами S и P обозначен остов каждой отдельной спирали, состоящей из чередующихся остатков сахара и фосфорной кислоты; A, T, G и C означают четыре типа оснований - аденин, тимин, гуанин и цитозин; точечные линии - водородные связи, удерживающие две спирали вместе. В рамке показаны две водородные связи между аденином и тимином и три - между гуанином и цитозином
Информация, заключенная в клеточной ДНК, выполняет в клетке две важные функции. Во-первых, она обеспечивает непрерывность ДНК от клетки в клетке, поскольку ДНК играет роль матрицы также и при своем собственном воспроизведении. Во-вторых, эта информация используется для синтеза специфичных клеточных белков при участии промежуточных продуктов - разных типов рибонуклеиновых кислот (РНК). РНК отличается от ДНК тем, что входящий в ее состав сахар (рибоза) содержит на один атом кислорода больше, чем дезоксирибоза ДНК. Однако это на первый взгляд незначительное различие приводит к весьма существенным различиям в конфигурации и геометрии молекул этих двух нуклеиновых кислот.
Закручивание двух спиральных цепей ДНК в двойную спираль достигается в результате образования между парами оснований водородных связей (принадлежащих к числу слабых связей). Аденин и тимин сближаются, например, вследствие того, что два атома водорода осциллируют между атомами азота и кислорода групп
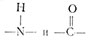
двух соседних колец в молекулах аденина и тимина (рис. 2.10, вставка). Можно, следовательно, сказать, что спаривание оснований А и Т, т. е. образование пары A-T, естественным образом определяется самой структурой этих молекул. Точно так же (на этот раз за счет трех водородных связей) образуют специфичную пару G-C гуанин и цитозин. Из этой специфичности следует, что если в матричной цепи закодирована какая-нибудь информация, то вновь синтезированная цепь, построенная на этой матрице, неизбежно должна содержать комплементарную информацию. Если затем эта новая цепь в свою очередь будет использована как матрица, то синтезированная на ней цепь будет представлять собой копию исходной матрицы.
В составе двойной спирали две цепи молекулы ДНК тесно закручены одна вокруг другой и потому неспособны участвовать в синтезе, но если спираль раскручивается, то способность к синтезу реализуется, причем проявляться она может по-разному. В присутствии фермента ДНК-полимеразы и смеси четырех дезоксирибонуклеотидов (в форме, богатой энергией, а именно в форме соответствующих трифосфатов) синтезируется новая цепь ДНК, комплементарная существующей. На другом этапе клеточного цикла в присутствии РНК-полимеразы и смеси четырех рибонуклеотидов (также в форме трифосфатов) на той же ДНК-матрице вместо ДНК синтезируется РНК. Единственное различие в кодировании оснований заключается в том, что при синтезе РНК в строящуюся цепь вместо тимина, присутствующего в ДНК, включается урацил (U). Таким образом, водородные связи А-Т, характерные для ДНК, заменяются в РНК связями А-U; связи G-С присутствуют в молекулах обеих этих нуклеиновых кислот (рис. 2.11).
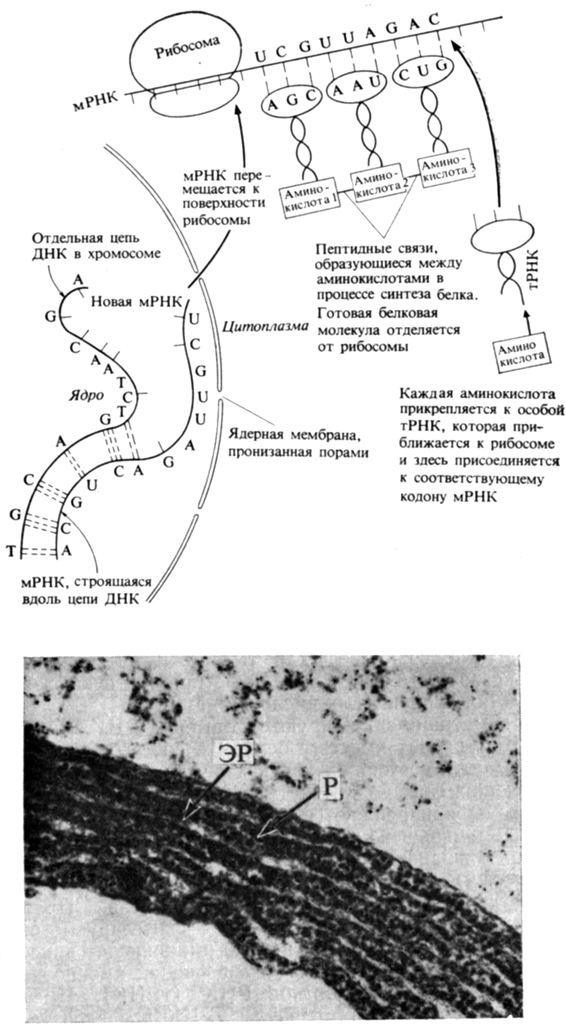
Рис. 2.11. Синтез белка и роль РНК в этом процессе. (С любезного разрешения Boylan M., Yale University.) Внизу - электронная микрофотография, на которой видны рибосомы (Р), прикрепленные к мембранам эндоплазматического ретикулума (ЭР) в клетке семядоли Phaseolus vulgaris. Синтезируемый белок поступает в таких случаях непосредственно в просвет эндоплазматического ретикулума. X53 000
На ДНК-матрице синтезируются три вида РНК. Рибосомная РНК (рРНК) входит вместе с белком в состав рибосом - клеточных органелл, состоящих из двух разных по величине половинок, имеющих форму сплюснутых сфер, прижатых одна к другой. Рибосомы прикрепляются к матричной (информационной) РНК (мРНК) меньшей своей субъединицей; группа таких рибосом, прикрепившаяся к нити мРНК, образует полирибосому (или полисому), которая представляет собой не что иное, как готовый к действию аппарат белкового синтеза. Правильное расположение аминокислот в молекуле синтезируемого белка обеспечивается тем, что каждая из 20 аминокислот присоединяется сначала к молекуле особой, специфичной именно для данной аминокислоты, транспортной РНК (тРНК). Имеющаяся в ключевом участке этой молекулы тРНК последовательность из трех нуклеотидов "узнает" (путем образования водородных связей) комплементарный ей нуклеотидный триплет в связанной с рибосомами цепи мРНК и прикрепляется к цепи именно в этой точке. Таким образом, нагруженные аминокислотами тРНК доставляют эти аминокислоты к растущей линейной последовательности соединенных друг с другом аминокислот (т. е. к вновь синтезируемому белку) в совершенно определенном порядке. Доставив аминокислоту на место, специфичная тРНК отделяется от нее и опять оказывается готовой для очередного цикла переноса аминокислоты. В определенной точке цепи мРНК имеется "стоп-сигнал" - нуклеотидный триплет, обрывающий синтез и вызывающий отделение готового белка от рибосомы. Каждая из единиц этого ансамбля (рибосома, тРНК, мРНК) может участвовать в таком цикле много раз подряд, хотя все они, разумеется, в конечном счете обречены на распад и, значит, периодически должны обновляться.
Аминокислоты и генетический код
Белковые молекулы представляют собой линейные полимеры аα-аминокислот (рис. 2.12), соединенных пептидными связями. Пептидная связь (
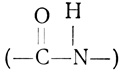
), общая для всех белков, образуется в результате соединения карбоксильной группы одной аминокислоты с аминогруппой другой. Порядок включения аминокислот в растущую полипептидную цепь, синтезируемую на рибосоме, задан порядком расположения нуклеотидов в матричной РНК, присоединенной к рибосоме, что в свою очередь обусловлено последовательностью нуклеотидов в ДНК. Включение в цепь каждой отдельной аминокислоты определяется группой из трех последовательно расположенных нуклеотидов, которую называют триплетом, или кодоном. Для некоторых аминокислот существует только один такой кодон, а для других - несколько. В табл. 2.1 представлены все 64 возможные комбинации по три нуклеотида и указан их "смысл" на языке аминокислот (U, C, A и G означают здесь урацил, цитозин, аденин и гуанин соответственно). Считается, что этот код универсален, т. е. свойствен всем формам жизни.
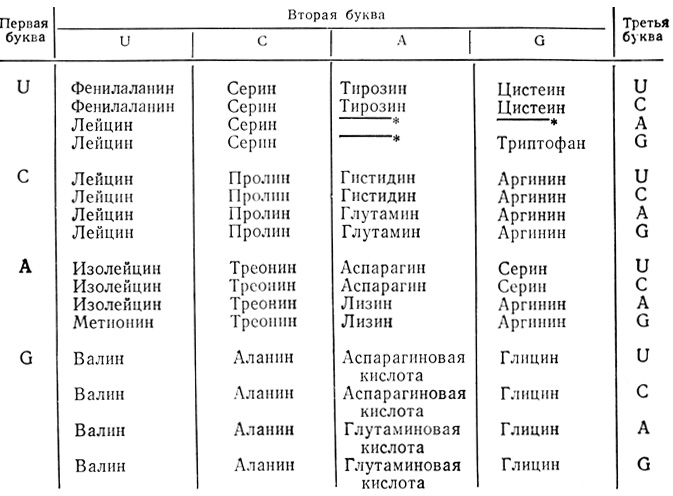
Таблица 2.1. Генетический код
(На этих кодонах цепь обрывается и синтезированные полипептиды отделяются от рибосомы.)
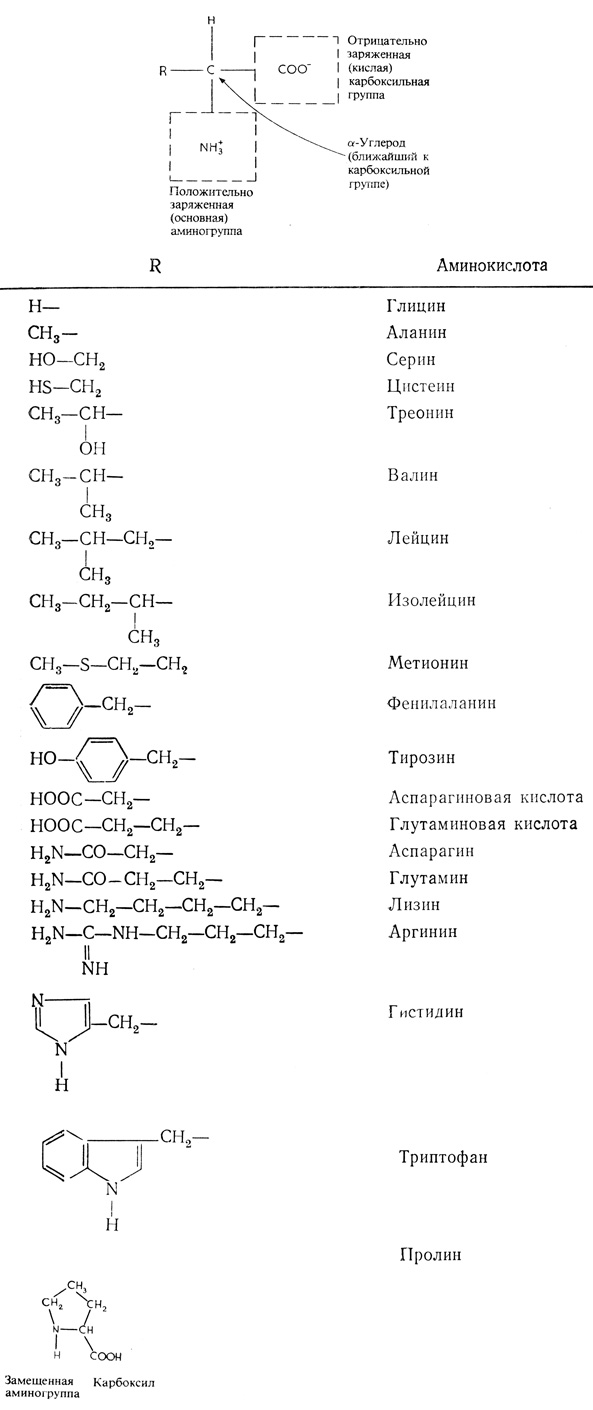
Рис. 2.12. Структура аминокислот. Специфические свойства каждой из 20 аминокислот, входящих в состав белков, определяются ее боковой цепью (R). Молекула пролина замкнута в кольцо вследствие того, что заместителем в аминогруппе служит собственная боковая цепь аминокислоты
Ферменты
Многие из белков, синтезируемых на рибосомах, регулируют скорость определенных клеточных реакций. Такие белки, обладающие специфической каталитической активностью, называются ферментами. Ферменты играют в клетке ключевую роль; именно от них зависит в конечном счете вся природа клетки, поскольку они регулируют химические реакции, в которых синтезируются те или иные клеточные компоненты. У некоторых растений, например, наследственно закрепленное различие между разновидностями с красными и белыми цветками обусловлено различием в одной-единственной паре генов. В клетках лепестков у разновидности с красными цветками имеется фермент, способный превращать бесцветное вещество-предшественник в красный пигмент; у разновидности с белыми цветками такого фермента нет. Ядерная ДНК определяет цвет лепестков путем регуляции синтеза этого цитоплазматического фермента, катализирующего образование окрашенного вещества из бесцветного (рис. 2.13). В цитоплазму этот ядерный контроль передается при посредстве матричной РНК, синтезируемой в ядре, но проявляющей свою активность в цитоплазме, на рибосомах.
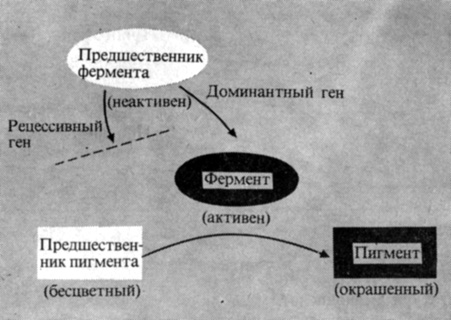
Рис. 2.13. Гены контролируют синтез специфичных ферментов, которые в свою очередь контролируют химизм клетки
В любой клетке содержатся тысячи ферментов, и каждый из них регулирует какую-нибудь химическую реакцию или группу взаимосвязанных реакций. Многие ферменты были выделены из клетки, подвергнуты очистке, а затем закристаллизованы. Оказалось, что все ферменты представляют собой белки или состоят преимущественно из белка. Некоторые ферменты содержат небольшую простетическую группу небелковой природы. У других молекула способна диссоциировать на две части - большую белковую (апофермент) и меньшую небелковую (кофермент) (рис. 2.14). В таких случаях ни апофермент, ни кофермент по отдельности не обладают каталитической активностью; при диссоциации каталитическая активность исчезает, но она может полностью восстановиться, если кофермент и апофермент соединятся вновь. Небольшие количества определенных металлов и витаминов играют важную роль в различных физиологических процессах, поскольку эти металлы или витамины являются коферментами тех или иных специфических ферментов; в их отсутствие фермент не способен функционировать и биохимия клетки приобретает аномальный или даже патологический характер. В состав некоторых ферментов входят, помимо белка, углеводы, липиды или какие-нибудь иные компоненты. В таких случаях говорят о гликопротеидах, липопротеидах и т. п.
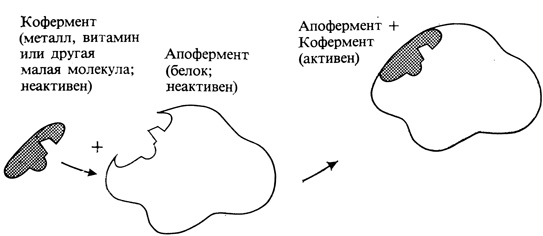
Рис. 2.14. Молекулы некоторых ферментов состоят из крупной белковой части, пли апофермента, и значительно меньшего по своим размерам кофермента. В таких случаях активностью обладает только комплекс апофермент-кофермент
Функцию коферментов выполняют такие металлы, как железо, марганец, цинк, молибден и магний, и такие витамины, как тиамин, рибофлавин, никотиновая кислота и пиридоксин. Лак в той, так и в другой группе активный кофермент - это иногда не просто металл или витамин, а более сложная структура. Железо, например, может входить в состав гема; оно занимает центральное положение в этой сложной органической молекуле, содержащейся в гемоглобине и некоторых важных окислительных ферментах. Тиамин, рибофлавин и никотиновая кислота встречаются в виде фосфорилированных производных, обеспечивающих активность ряда дыхательных ферментов. Среди так называемых металлфлавопротеидов имеются ферменты, которые нуждаются в нескольких типах коферментов; так, альдегидоксидаза в активной форме содержит (помимо основного структурного белка) еще и свободное железо, железо в составе гема и, наконец, рибофлавин в комплексе, носящем название флавин-адениндинуклеотид. Все эти коферменты необходимы для проявления активности альдегидоксидазы, причем, для того чтобы быть эффективным, каждый из них должен быть присоединен к белку в соответствующем положении.
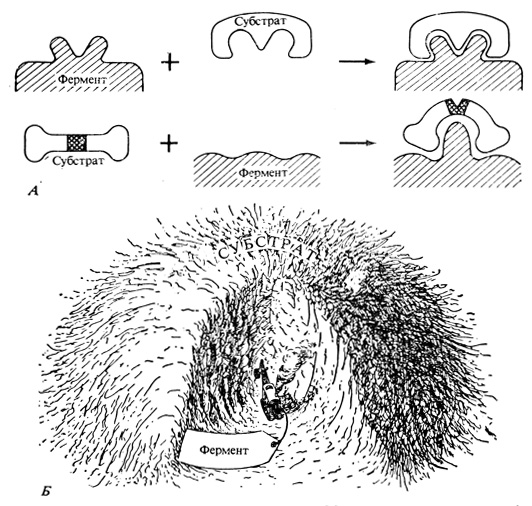
Рис. 2.15. А. Фермент-субстратный комплекс. Молекулы некоторых ферментов и субстратов подходят друг к другу по форме, как отдельные части головоломки (вверху). В других случаях фермент, связываясь с субстратом, изменяет свою конформацию (внизу). Новая конформация фермента влияет и на конформацию молекулы субстрата. (С изменениями по Koshland D. E., Neet K. E. 1968. Ann Rev. Biochem., 37, 359-410.) Б. Молекулы ферментов выполняют гигантскую работу, никак не сопоставимую с их размерами. (Bonner J., Galston A. W. 19(52. Principles of Plant Physiology, San Francisco, Freeman W. H. and Co.)
Ферменты катализируют самые разнообразные химические реакции - синтез, распад, гидролиз, окисление, восстановление и перенос групп (таких, как аминогруппы, метальные группы или остатки фосфорной кислоты). Обычно один фермент катализирует только одну какую-нибудь реакцию или один тип реакций. По-видимому, все ферменты осуществляют свою функцию одним и тем же путем - сначала они образуют химический комплекс с теми веществами, на которые действуют (т. е. со своими субстратами). Этот фермент-субстратный комплекс претерпевает затем некоторые внутренние перестройки, вызывающие изменения в молекуле субстрата и в конечном итоге приводящие к высвобождению продуктов реакции (рис. 2.15, А). Представим себе, что две малые молекулы A и B способны медленно вступать в соединение с образованием более крупной молекулы AB и что фермент E ускоряет (катализирует) эту реакцию. Суммарная реакция
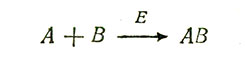
состоит, как можно показать, из следующих этапов:
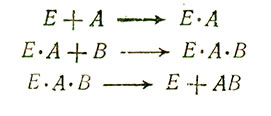
Суммируя эти уравнения, мы и получим реакцию A+B→AB, в которой фермент в качестве участника реакции не фигурирует. Фермент в суммарной реакции выступает как катализатор благодаря тому, что на последнем этапе происходит его регенерация; небольшого количества фермента оказывается достаточно для того, чтобы вызвать весьма значительные общие изменения на уровне субстрата и продукта (см. рис. 2.15, Б). Во многих случаях скорость катализируемой ферментом реакции изменяется с увеличением концентрации субстрата [S] так, как показано на рис. 2.16. При постоянной концентрации фермента зависимость между u и [S] оказывается почти линейной до тех пор, пока [S] мала, т. е. пока добавление каждой новой единицы S увеличивает количество ES; однако v почти не зависит от [S] при высоких значениях [S], т. е. тогда, когда практически весь фермент находится в форме ES. Построив график двойных обратных величин, т. е. график зависимости 1/u от 1/[S], мы получим прямую (рис. 2.17). Преимущество этого способа изображения состоит в том, что он позволяет анализировать биохимическую реакцию при нарушении функции фермента. Известно, например, что при действии некоторых ингибиторов, конкурирующих с субстратом за связывание с активным центром фермента, изменяется наклон прямой, но не изменяется величина отрезка, отсекаемого этой прямой на оси ординат. Подобный анализ полезен тогда, когда требуется изыскать какой-нибудь способ, который позволил бы вывести фермент из блокированного состояния.
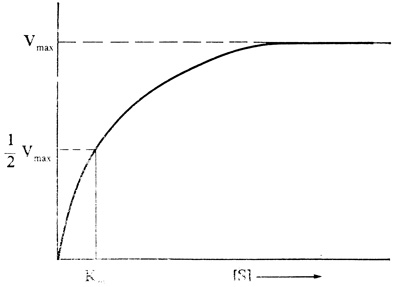
Рис. 2.16. График, описывающий зависимость между скоростью катализируемой ферментом реакции и концентрацией субстрата для случая, когда концентрация фермента постоянна. Vmax - максимальная скорость, достигаемая, когда все активные центры фермента связаны с субстратом. Km - концентрация субстрата при 1/2 Vmax
Итак, клеточные ферменты, локализующиеся в различных клеточных органеллах или в цитоплазме, непосредственно управляют деятельностью всего биохимического аппарата клетки.
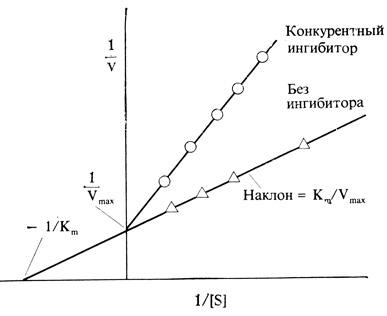
Рис. 2.17. Тот же график для катализируемой ферментом реакции представляет собой прямую, если он описывает зависимость между величиной, обратной скорости реакции, и величиной, обратной концентрации субстрата (график двойных обратных величин). Прямая пересекает ось ординат в точке 1/Vmax а ее пересечение с осью абсцисс (при экстраполяции) дает 1/Km. При действии конкурентного ингибитора (т. е. ингибитора, конкурирующего с субстратом за связывание с активным центром фермента) изменяется наклон прямой, но не величина Vmax
Все клетки таковы, каковы они есть, благодаря своему химизму; химизм клеток определяется ферментами; природа ферментов определяется цитоплазматической РНК; специфичность же этой РНК в свою очередь определяется ДНК, содержащейся в ядре и в некоторых других клеточных органеллах.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'