
Мембраны
Протопласт снаружи и изнутри ограничен мембранами - плазмалеммой и тонопластом; плазмалемма отделяет его от клеточной стенки, а тонопласт - от вакуоли. В электронном микроскопе (при увеличении в миллион раз и более) эти мембраны, соответствующим образом окрашенные, выглядят как две темные полосы, расположенные на расстоянии 6-10 нм друг от друга ( рис. 2.3). В протопласте имеются также различные тельца, так называемые органеллы. Среди них прежде всего бросаются в глаза одно крупное ядро и многочисленные более мелкие митохондрии и хлоропласты (рис. 2.3 и 2.4). У каждой из органелл есть свои функции. Эти функции осуществляются в уникальной внутренней среде, создаваемой избирательной проницаемостью и другими специфическими свойствами мембран, окружающих органеллу и отделяющих ее от всего остального протопласта. Избирательная проницаемость означает, что различные вещества проникают сквозь данную мембрану с разными скоростями, в основном по причине разной их растворимости в отдельных компонентах мембраны. Кроме того, в мембранах имеются также своеобразные "насосы", т. е. системы, активно перекачивающие через мембрану те или иные вещества с использованием для этой цели энергии. Результатом такой деятельности оказывается неравномерное распределение некоторых веществ или элементов: калий, например, присутствует обычно в протопласте в значительно более высокой концентрации, нежели в наружной среде, тогда как родственный ему элемент натрий у большинства растений практически "выталкивается" из протопласта.
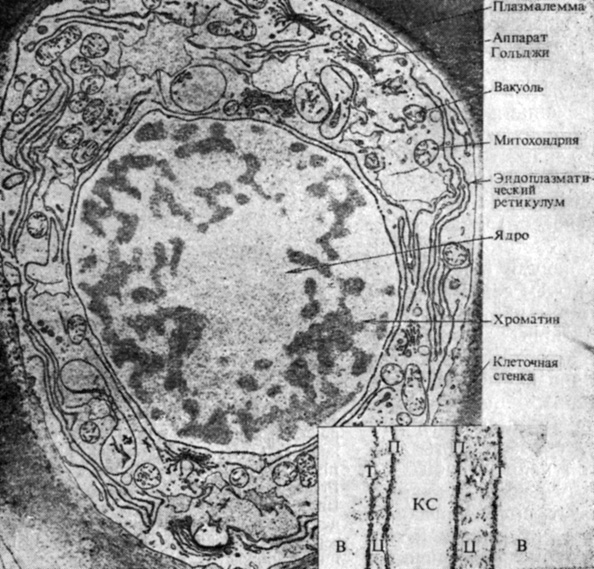
Рис. 2.3. Электронная микрофотография клетки из кончика корня кукурузы, (С любезного разрешения Whaley W. G. и лаборатории электронной микроскопии Техасского университета.) Поперечный срез сделан на расстоянии 75 мкм от кончика корня. Крупное тело в центре клетки - ядро; видны более темные скопления хроматина и множество пор в двойной ядерной мембране. Длинные канальцы, пронизывающие цитоплазму, - участки эндоплазматического ретикулума, представляющего собой выросты двойной ядерной мембраны. Многочисленные округлые или утолщенные с одного конца тельца с обращенными внутрь мембранными выростами - митохондрии с их кристами. Собранные в плотные группы короткие канальцы, от концов которых отшнуровываются пузырьки, - аппарат Гольджи. Более светлые участки, отмеченные точечной штриховкой, - вакуоли. На вставке справа видны плазмалемма (П) и тонопласт (Т) двух соседних клеток при большем увеличении. В - вакуоль; Ц - цитоплазма; КС - клеточная стенка, общая для двух клеток. Обратите внимание, что каждая мембрана состоит из трех слоев - двух наружных гидрофильных, непрозрачных для электронов (параллельные темные линии), разделенных внутренним гидрофобным слоем, прозрачным для электронов (светлая полоса). (С любезного разрешения Israel H. W., Cornell University.)
Методом дифференциального центрифугирования мембраны выделяют из клеток (при этом в осадке оказывается смесь различных мембран) и подвергают химическому анализу. В процессе выделения мембраны обычно рвутся, поскольку это структуры тонкие и хрупкие, с весьма большой площадью поверхности; однако затем концы их фрагментов часто сливаются, и тогда возникают сферические пузырьки. Анализ таких пузырьков, полученных из большого числа различных мембран, выявил в них присутствие двух главных компонентов: белка и фосфолипида, Липиды из разных мембран в достаточной мере сходны, что же касается белков, то каждому типу мембран свойствен свой тип белка, соответствующий тем физиологическим функциям, которые данная мембрана выполняет в клетке. Известно, например, что активные белки (ферменты), регулирующие транспорт минеральных веществ - поступление их в клетку и выход из клетки, - локализуются в плазмалемме и тонопласте; ферменты, участвующие в фотосинтезе, сосредоточены в мембранных системах зеленых хлоропластов; и наконец, ферменты, катализирующие окислительные реакции процесса дыхания, находятся в митохондриальных мембранах.
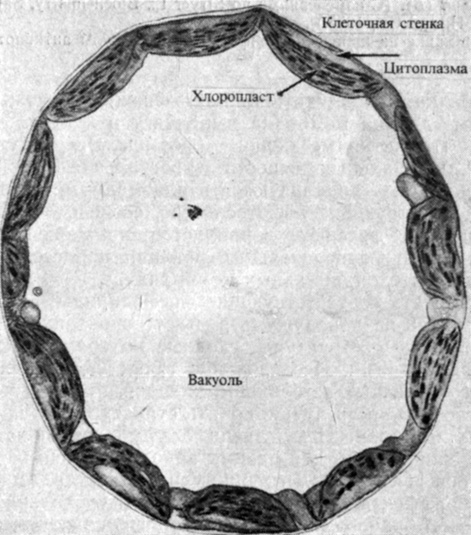
Рис. 2.4. Электронная микрофотография клетки из ткани зеленого листа - органа фотосинтеза. Многочисленные хлоропласты окружают крупную центральную вакуоль в цитоплазме. (С любезного разрешения Israel Н. W., Cornell University.)
Если смешать соответствующие фосфолипиды и белки и нанести эту смесь на поверхность воды, то спонтанно образуются мембраноподобные структуры, сходные по толщине с биологическими мембранами. Исследование таких искусственных мембран, приготовленных из белков и липидов природных мембран, дает нам возможность лучше понять структуру и функцию биологических мембран. Искусственные мембраны обнаруживают разную проницаемость для разных ионов в зависимости от природы белков и липидов, входящих в их состав. Чрезвычайно интересные эффекты можно наблюдать при добавлении к искусственным мембранам некоторых антибиотиков. Валиномицин, например, благодаря своей структуре (т. е. определенным размерам и заряду молекулы) оказывается способным притягивать и удерживать ионы калия, но не притягивает ионов натрия (рис. 2.5). Если добавить валиномицин к искусственной мембране, отделяющей растворы с ионами K+ и Na+ от чистой воды, то скорость перемещения ионов К+ через мембрану возрастет в несколько раз, тогда как скорость переноса ионов Na+ останется практически неизменной. Иначе действует грамицидин, молекула которого имеет иные размеры и другую структуру: при добавлении к мембране грамицидина увеличивается скорость переноса обоих ионов - не только K+, но и Na+. Искусственные мембраны используются также для изучения механизмов, при помощи которых свет и гормоны регулируют рост растений (об этом мы будем говорить в гл. 11).
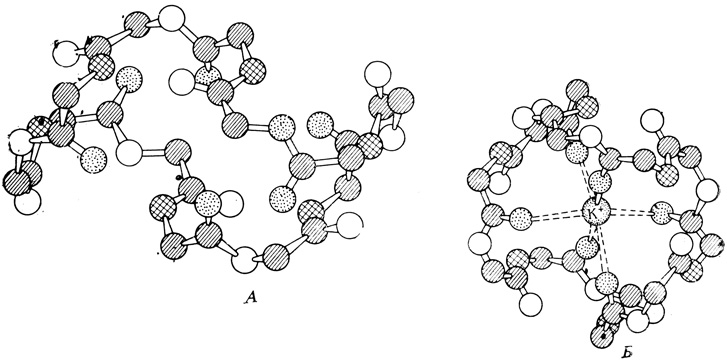
Рис. 2.5. Модель структуры валиномицина до связывания иона K+ (A) и после связывания (В). (С изменениями по Stryer L., Biochemistry, San Francisco: Freeman W. H. and Co., 1975.) Обратите внимание на изменение конформации молекулы антибиотика
Плазмалемма обращена одной своей стороной к клеточной стенке, а другой - к цитоплазме; обе эти оводненные структуры контактируют, как принято считать, с гидрофильными, заряженными участками мембран. Поскольку белки содержат больше заряженных групп, чем липиды, в первых моделях мембран предполагалось, что плазмалемма состоит из двух наружных белковых слоев (две темные линии на рис. 2.3) и одного липидного слоя между ними. Такая модель мембранной структуры оставалась общепризнанной до начала 1970-х гг., когда были получены некоторые новые данные и стало ясно, что модель нуждается в пересмотре. Несовместимыми с этой моделью "сэндвича" оказались, например, данные электронной микроскопии, полученные методом замораживания - травления. Исследуемую ткань сначала замораживают в жидком азоте, а затем раскалывают тупым микротомным ножом, так что скол проходит в плоскости, параллельной поверхности мембраны (рис. 2.6). После этого образец выдерживают под вакуумом для возгонки льда (сублимации). Эта процедура и называется травлением. Затем образец напыляют углем или металлом, чтобы выявить детали строения обнажившейся поверхности. Полученная таким образом реплика (копия) поверхности препарата и является объектом электронно-микроскопического исследования (рис. 2.7). На таких репликах видны вкрапленные в гладкую поверхность мембраны крупные частицы - глобулярные белки. Наличие особого "рисунка" поверхности мембраны удалось подтвердить и другим методом, а именно с помощью лектинов - особых белков (их выделяют из семян), которые прикрепляются к дискретным и специфическим белковым рецепторам на мембранной поверхности и позволяют выявить эти рецепторы.
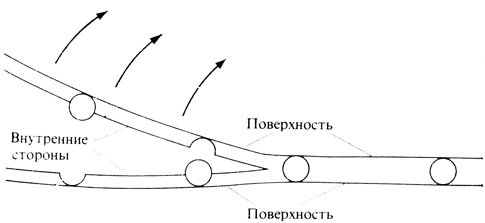
Рис. 2.6. Чтобы подготовить мембранные фрагменты для исследования в электронном микроскопе по методу замораживания-травления, эти фрагменты быстро замораживают в жидком азоте, а затем раскалывают микротомным ножом. Мембрана обычно раскалывается в плоскости, параллельной ее наружным поверхностям, т. е. она как бы расщепляется, обнажая свое внутреннее строение. После этого удаляют лед возгонкой под вакуумом и обнажившиеся участки напыляют углем или платиной. На препаратах видны и вкрапленные в мембрану частицы, и соответствующие им углубления в толще мембраны
Результаты, полученные этими и некоторыми другими методами, дали возможность предположить, что мембраны имеют мозаичное строение и состоят из липидного матрикса, в который в разных местах вкраплены белки (рис. 2.8). Такая модель учитывает, что не все участки белковой молекулы гидрофильны, а липиды не полностью гидрофобны. Согласно этой модели, заряженные (полярные) группы белковых и липидных молекул находятся на наружной поверхности мембраны, в контакте с клеточной водой, а незаряженные (неполярные) группы образуют внутреннюю гидрофобную часть мембраны. Предполагается также, что одни белки непрочно прикреплены к наружной поверхности мембраны, тогда как другие (так называемые интегральные белки) пронизывают всю толщу мембраны. К такому заключению приводят биохимические эксперименты: они показывают, что часть белков легко отделяется от мембран, а отделение других оказывается возможным лишь после полного распада мембранной структуры.
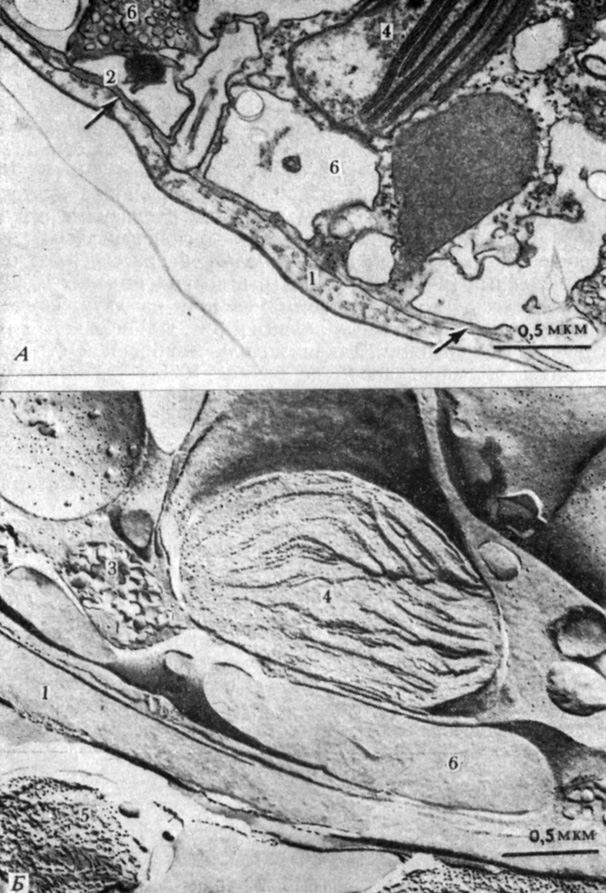
Рис. 2.7. Электронные микрофотографии участка фиксированной клетки одноклеточной водоросли Gonyaulax polyedra (А) и реплики нефиксированной клетки (5), полученной методом замораживания-травления. G. polyedra принадлежит к Dinoflagellata и имеет два жгутика, каждый из которых лежит в особой бороздке. (Sweeney В. М. 1976. J. Cell Biol., 68, 451-461.) При изготовлении реплики методом замораживания-травления расщепились многие клеточные мембраны и обнажились внутренние их стороны. Маленькие округлые выступы на микрофотографии реплики - это, по-видимому, содержащиеся в мембране белки. Часть из них явно находится в цитоплазматической мембране, но многие локализуются в хлоропласте, где они, по всей вероятности, входят в состав тилакоидных мембран. 1 - пелликула, главная защитная? 'кожица' клетки; 2 - плазматическая мембрана; 3 - поливезикулярное тельце; 4 - хлоропласт; 5 - часть целлюлозной пластинки; 6 - часть периферического пузырька. (X40 000 для обеих микрофотографий.)
На основании первых исследований структура мембран представлялась нам стабильной и жесткой, однако в последнее время быстро накапливаются данные, свидетельствующие о том, что по крайней мере липидный компонент мембран имеет жидкостную природу и, следовательно, мобилен. Кроме того, опыты с радиоактивно меченными предшественниками отдельных мембранных компонентов показали, что скорость метаболического обновления некоторых участков мембраны очень высока, т. е. что эти участки непрерывно разрушаются и ресинтезируются. Вводя меченые предшественники в зрелую ткань, мы можем наблюдать, как они включаются в мембраны, остаются в них на протяжении нескольких часов, а затем исчезают из мембран и обнаруживаются в каких-нибудь других частях клетки.
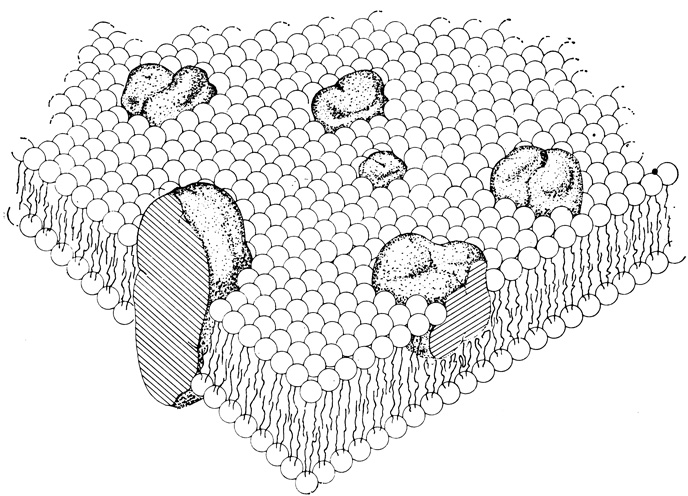
Рис. 2.8. Жидкостная мозаичная модель мембраны: схематическое трехмерное изображение и поперечный разрез. (Singer S. J., Nicolson G. L. 1972. Science, 175, 720-731.) Крупные частицы - белки. Одни из них пронизывают всю толщу мембраны, а другие закреплены в ней более рыхло. Маленькие шарики, от каждого из которых отходят по две вертикальные линии, изображают молекулы фосфолипидов. Шарик соответствует гидрофильной части молекулы, а вертикальные линии - ее длинным гидрофобным углеводородным хвостам
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'