
Подходы к исследованию клетки
Биологи изучают клетки различными методами. На первом месте среди них естественно назвать прямое визуальное наблюдение, однако такому наблюдению поддаются лишь самые крупные клетки. Для более мелких требуется увеличение, которого можно достичь при помощи простой лупы (приблизительно 10X) или обычного микроскопа, имеющего систему линз (до 1000X). В световом микроскопе живая трехмерная клетка представляется иногда очень сложным, изменчивым и неупорядоченным образованием. Стремясь к получению более простой и стабильной картины, биологи научились убивать клетки и сохранять их путем погружения в какой-нибудь фиксатор, например в формальдегид. Убитые и фиксированные клетки отмывают, обезвоживают проведением через спирт, заливают в какую-нибудь плотную среду, например в парафин или пластмассу, а затем приготовляют из них тонкие срезы с помощью бритвы или микротома. При благоприятных условиях микротом дает возможность получать срезы толщиной от 1 до 10 мкм. Для того чтобы выявить отдельные клеточные структуры, эти тонкие срезы помещают последовательно в различные красители, отличающиеся друг от друга растворимостью и молекулярным зарядом и вследствие этого адсорбируемые разными клеточными структурами. При достаточно тщательной работе и соответствующем навыке можно таким путем получить картину, в которой отдельные клеточные структуры будут окрашены по-разному, скажем ядерный материал - в розовый цвет, цитоплазматические структуры - в зеленый или фиолетовый с разными оттенками, а клеточные стенки не окрашены вообще или окрашены еще в какой-нибудь цвет. Почти все из того, что мы теперь знаем о клетке, ученые выяснили именно таким способом, используя различные методы фиксации материала, заливки его в среду, приготовления срезов и окрашивания.
Еще большее увеличение (до 1 000 000X) обеспечивает электронный микроскоп. В нем вместо светового пучка используется пучок электронов, что дает возможность получить большее разрешение, поскольку разрешающая способность обратно пропорциональна длине волны используемого излучения, а длины волн де Бройля электронов очень малы по сравнению с длинами волн видимого диапазона спектра. Теоретический предел разрешения в электронном микроскопе пока не достигнут. Объясняется это тем, что электрический "шум" в магнитных линзах, фокусирующих пучок электронов, делает изображение нестабильным. Однако недавние усовершенствования, рассчитанные на то, чтобы снизить этот "шум" (например, сильное охлаждение линз), позволяют надеяться, что в конце концов в электронном микроскопе удастся достичь еще большего разрешения.
Для электронной микроскопии из залитых в пластмассу клеток приготовляют тонкие срезы при помощи алмазных или стеклянных ножей. Затем срезы обрабатывают такими реагентами, как четырехокись осмия; эти реагенты избирательно присоединяются к различным клеточным структурам и делают их в разной мере непрозрачными для электронов. После этого на? фотографической пластинке или на флуоресцентном экране изучают детали полученной картины. Структуры на электронных микрофотографиях не окрашены - они черные, белые или серые; получать цветные изображения мы пока еще не научились.
Еще один способ получения информации о клетках связан с химическим исследованием выделенных клеточных органелл. Если осторожно растереть клеточную массу в соответствующей среде, то по крайней мере часть клеточных органелл можно выделить в интактном виде. Органеллы, имеющие различную плотность, разделяют центрифугированием при постоянно возрастающем числе оборотов (рис. 2.1). Например, такие тяжелые частицы, как ядра и хлоропласты, осаждаются при сравнительно небольших скоростях, соответствующих центробежным силам, в 1000-3000 раз превышающим силу земного притяжения (1000-3000 g); митохондрии переходят в осадок примерно при 10 000 g, рибосомы - приблизительно при 30000 g, а для более мелких частиц и для крупных молекул может потребоваться и еще в 100 раз большая скорость центрифугирования. Дифференциальное центрифугирование наряду с другими методами (ступенчатым фильтрованием, физической абсорбцией и элюцией или разделением по величине электрического заряда) позволяет получать в достаточных количествах отдельные виды клеточных органелл или их фрагментов. Полученные хлоропласта, митохондрии, рибосомы, мембраны и прочие фрагменты используются затем для экспериментов, цель которых состоит в том, чтобы определить химическую природу и биохимическую активность каждой из этих выделенных фракций.
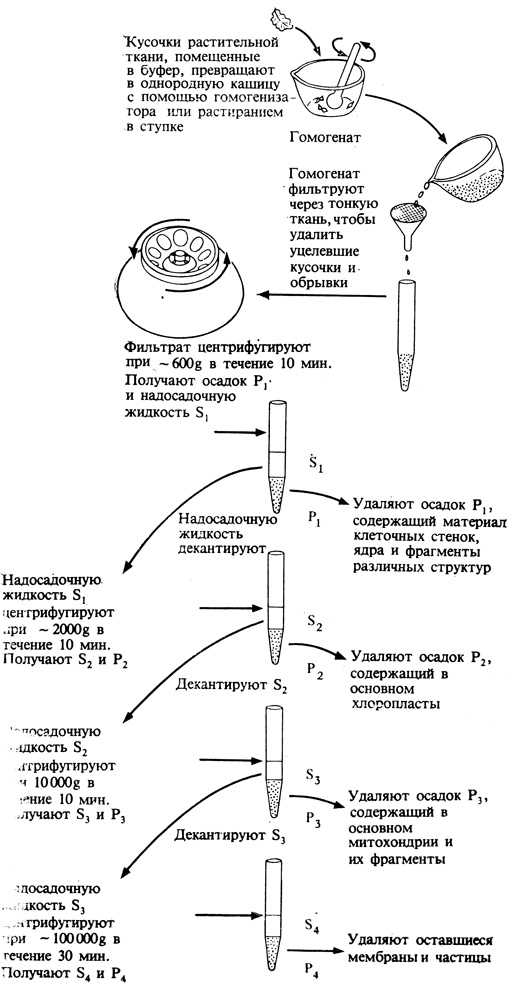
Рис. 2.1. Разделение клеточных фракций методом дифференциального центрифугирования
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'