
Большая "семья" флавонолов и флавонов
Говорят, очам полезно
видеть желтое - ах, где же
Кипарис в одеждах розы,
что пылает желтым жаром?
Алишер Навои
Чем "пылят" растения? - Вещества оплодотворения? - Имена дают растения. - Не распаханное до конца поле. - Кто любит свет, а кто лишь темноту. - Сглаженная конкуренция. - Химическая прополка и флавоновые вещества. - "Пиррова победа"? - Флавонолы, флавоны и рост. - Защитники сильного. - Чем "плачут" березы? Вместе с известным витамином. - Желтая аптека.
Прогуливаясь в конце весны по сосновому лесу, присмотритесь к его внутреннему миру. Ваше внимание обязательно привлечет не только живительный смолистый аромат и приглушенный шелест разлапистых веток с их многочисленными хвоинками, - листочками. В эту пору года вы не можете не заметить обилия золотисто-желтой пыльцы, туманной завесой обволакивающей деревья. Сосновый лес "пылит". Ветер разносит пылинки на большие расстояния и производит опыление женских шишечек сосны, при этом пыльца одних деревьев попадает на шишечки других. Пылит, впрочем, не только сосна. Пылят многие деревья и кустарники, пылят травянистые растения. Если же ко времени вашего посещения леса прошел хотя бы небольшой дождь, заполнивший разъезженную колею лесной дороги лужицами воды, вы непременно обнаружите на их поверхности тончайшую пленку, сверкающую желтизной, - массовое скопление цветочной пыльцы, сбитой дождевыми каплями. Покрывая близлежащие водоемы, она служит отменным лакомством для мальков рыб.
Величайший знаток природы и тонкий пейзажист М. М. Пришвин в одной из своих зарисовок серии "Времена года" на сей счет подметил: "Пыльца цветущих растений так засыпала лесную речку, что в ней перестали отражаться береговое высокие деревья и облака". Что это: пример крайне высокой расточительности и "бесхозяйственности" в природе? Оказывается, ни то, ни другое. Это один из способов гарантии оплодотворения. Растения щедро расходуют свои пластические вещества, чтобы наверняка обеспечить зарождение новой жизни.
В процессе длительного развития растительного мира в природе сложилась и прижилась большая группа растений с самыми необыкновенными приспособлениями, препятствующими опылению собственной пыльцой (самоопылению). Они называются перекрестноопыляемыми. Сейчас хорошо известно, что только от перекрестного опыления, когда на рыльца пестиков попадает не своя, а чужая пыльца (при помощи ветра, насекомых), формируются наиболее крепкие и здоровые семена, дающие потомство таких организмов, которые способны противостоять различным жизненным невзгодам.
Природа оказалась щедрой на "выдумки", чтобы воспрепятствовать прорастанию собственной пыльцы на рыльце пестика у таких растений. Среди множества всевозможных препятствий к самоопылению у одних и тех же видов известно явление гетеростилии (от греческих "гетерос" - различный, "стилос" - столб) - разностолбчатости цветков. Заключается оно в том, что часть экземпляров одного и того же вида имеет длинные столбики пестиков, в результате чего они возвышаются над тычинками, а часть - короткие, спрятанные под собственные тычинки. Такая разностолбчатость не позволяет пыльце попадать на рыльце пестика с этого же цветка. Это явление характерно для гречихи, первоцвета, незабудки и ряда других растений. Опыление у них, как и у сосны, носит перекрестный характер. Прорастает у разностолбчатых растений только та пыльца, которая попала с тычинок короткостолбчатых цветков на рыльца пестиков длинностолбчатых. А если все же пыльца с тычинок одного вида цветков попадет на пестик того же самого (например, длинностолбчатого) вида? Она просто не прорастет и пылинки не дадут те живительные слизистые ниточки- трубочки, по которым содержимое их перетекает через столбик пестика в его завязь. Зарождение новой жизни не наступит. Почему?
Немецкий ученый Ф. Мевус (1953) определил, что пыльца короткостолбчатых и длинностолбчатых цветков содержит в себе гликозиды флавоноидов желтого цвета, отличающиеся друг от друга только остатками сахара, присоединенными к одному и тому же агликону - кверцетину. Он обратил внимание на тот факт, что в пыльце короткостолбчатых цветков находится кверцетин-3-рутинозид (рутин), а в пыльце длинностолбчатых - кверцетин-3-рамнозид (кверцитрин). Ученый предположил, что в момент готовности к оплодотворению, когда рыльца пестиков становятся влажными и "ждут" пыльцу, у короткостолбчатых цветков вырабатывается фермент, способный расщеплять только кверцитрин, у длинностолбчатых - только рутин. Тем самым рыльца пестиков короткостолбчатых цветков обеспечивают прорастание пыльцы только с тычинок длинностолбчатых цветков, и наоборот.
Это один из биологических механизмов, сложившихся в природе в течение миллионов лет, обеспечивающий жизненную несовместимость однотипных цветков и исключающий самоопыление у перекрестноопыляемых растений. Как видим, ведущая роль в этом механизме принадлежит желтым флавоноидам, получившим название флавонолов (от латинского "флавус" - желтый). Забегая вперед, отметим, что пыльца всех без исключения растений богата флавонолами, а также флавонами, которые совместно с каротином и другими каротиноидами придают ей золотисто-желтый цвет. И хотя в пыльниках тычинок вырабатывается огромное количество пыльцы, рассеиваемой в окружающее пространство (природа щедро "позаботилась" о будущем потомстве), соответствующие пылинки будут встречены пестиками только "подходящих" цветков. Большая "заслуга" в обеспечении такой жизненной совместимости принадлежит флавоновым веществам.
Советский биохимик С. И. Пашкарь (1970) определил, что у кукурузы на рыльцах пестиков еще задолго до встречи их с пыльцой образуется большое количество фенольных соединений. Через два часа после соприкосновения пылинок с рыльцем пестика обнаруживается усиленный полифенольный обмен, сопровождающийся повышением активности ферментов полифенолоксидазы и пероксидазы. Важную роль в этом обмене играют флавоноловые гликозиды, в частности гликозиды кверцетина и мирицетина. Особенно высоким содержанием их отличаются метелки кукурузы. Подчеркивая сложность процесса оплодотворения, С. И. Пашкарь отмечает, что в вопросах его регуляции, в "работе" по подготовке мужских и женских половых клеток к слиянию особая роль принадлежит флавоноловым гликозидам. Он называет их "веществами оплодотворения". К числу таких веществ в первую очередь относятся те флавонолы, которые имеют в своих молекулах метильные группы СН3 (например, изорамнетин и его производные).
Обсуждая роль флавонолов в половом процессе растений, B. Г. Минаева (1978) замечает, что эти флавоноиды выполняют неодинаковые функции в различных участках женской части цветка - гинеция. Так, в рыльцах пестиков и стенках завязей володушки, т. е. участках, обеспечивающих прорастание пыльцы и рост пыльцевых трубок, ведущее значение при оплодотворении принадлежит процессам распада флавонолов под действием ферментов. Каков же биологический смысл этого распада?
А смысл его заключается в освобождении сахаров, связанных с агликонами флавонолов, чтобы обеспечить питанием растущие пыльцевые трубки. В. Г. Минаева, так же как и C. И. Пашкарь, отмечает преимущественное накопление во всех частях цветка изорамнетина и его производных по сравнению о другими флавонолами. В частности, содержание его в ряду частей обвертки - лепестки - тычинки - пестики нарастает с одновременным падением содержания кверцетина и его производных. А если взять только пестик, то относительное содержание изорамнетина у него нарастает от рыльца к семяпочке (рис. 15). Автор полагает, что в процессе оплодотворения изорамнетин и его производные являются донорами метильных групп СН3, которые используются затем в качестве "строительного материала" для формирования молекул пектиновых веществ, служащих "каркасом" в оболочках растущих пыльцевых трубок.
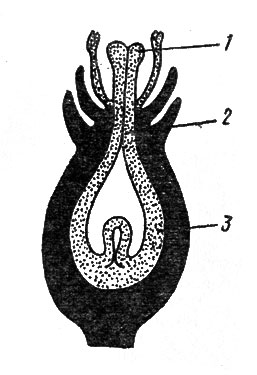
Рис. 15. Распределение изорамнетина в различных частях пестика володушки (по данным В. Г. Минаевой): 1 - рыльце; 2 - столбик; 3 - завязь
К флавонолам близко по своим свойствам примыкают флавоны. Это два наиболее обширных семейства флавоноидных соединений, которые с давних пор использовал человек в качестве природных красителей. М. Н. Запрометов (1974) отмечает, что первое из них объединяет в своем составе одних только агликонов около 70 штук, второе - свыше 40. Каждый агликон имеет собственное наименование. Основных агликонов в семействе флавонолов четыре: кверцетин, кемпферол, изорамнетин и мирицетин. Отличаются они друг от друга количеством групп ОН в боковом кольце молекулы. Кемпферол имеет одну такую группу, кверцетин - две, мирицетин - три. У изорамнетина, как уже говорилось выше, одна из двух групп ОН метилирована, т. е. атом водорода ее замещен группой СН3 (метил).
В семействе флавонов основных агликонов три: апигенин (имеет одну группу ОН в боковом кольце), лютеолин (две ОН-группы) и трицин (одна группа ОН и две - ОСН3).
Из флавонолов наиболее распространен в растительном мире кверцетин, выделенный впервые из коры дуба, за что и получил свое название (дуб по-латыни "кверкус"). Значительные количества его концентрируются в листьях винограда, конского каштана, клевера, гречихи, ясеня, хлопчатника, ряда садовых культур (боярышников, слив, груш и др.). Накапливается кверцетин как в виде агликона, так и в виде различных гликозидов. Мы уже упоминали о гликозидах кверцетина - рутине и кверцитрине. Первый из них распространен широко, но особенно много его в пыльце и лепестках. По этому гликозиду, обнаруженному впервые еще в 1842 г. в растениях руты (за что он и получил свое название), часто судят о широте "расселения" флавонолов по растительному миру. Он служит эталоном при количественных определениях этой группы флавоноидов в растительных тканях и органах.
Нахождение флавонолов и флавонов в виде гликозидов - характернейшая их особенность, сахарные остатки (чаще всего глюкозы, галактозы и рамнозы) присоединяются у 3-го углеродного атома, замещая атом водорода. В зависимости от растения, из которого были впервые выделены эти гликозиды, они и получили соответствующее название. Например, гиперин (кверцетин+сахар галактоза) был обнаружен первоначально в листьях зверобоя (по-латыни "гиперикум перфоратум"); астрагалин (кемпферол + глюкоза) - в цветках астрагала, трицин - в листьях пшеницы (по-латыни "тритикум") и т. д. Способность агликонов флавонолов и флавонов к массовому образованию гликозидов свидетельствует о высокой их активности.
А. П. Волынец и В. М. Кудрявцева (1978) нашли в пыльце и рыльцах пестиков тюльпанов огромные скопления флавоноловых гликозидов, которые они классифицировали на 5 групп. Весь фенольный комплекс пыльцы, по их наблюдениям, представлен в основном различными по своей структуре гликозидами кверцетина, кемпферола и изорамнетина, при этом отмечены весьма существенные различия в составе флавонолов у отдельных частей цветка. Например, моногликозиды флавонолов "заселяют" только пылинки тычинок, ди- и тригликозиды обнаруживаются лишь в пыльце, а дигликозиды, содержащие сахара монозу и биозу, находятся обычно в рыльцах пестиков. Авторы обоснованно предполагают, что каждой из обнаруженных групп флавонолов отводится "персональная" роль в опылении и оплодотворении. Характерно, что в рыльцах пестиков флавоноловых гликозидов содержится, как правило, в 3-4 раза меньше, чем в пыльце.
Сформировавшиеся молекулы гликозидов флавонолов и флавонов очень часто не остаются в неизменном виде. Они вступают в реакции ацилирования, т. е. присоединения остатков кислот. Об этих реакциях мы уже говорили при рассмотрении антоцианов и катехинов. Как и катехины, флавонолы, например, довольно "охотно" присоединяют ацилы. Разница только в том, что катехины "стремятся к захвату" остатков галловой кислоты, относящейся к так называемому ряду оксибензойных кислот (или С6-C1-соединений), в результате чего образуются, как мы уже говорили, галлированные катехины.
Флавонолы же "предпочитают" оксикоричные кислоты (С6-С3-соединения), и в первую очередь - паракумаровую кислоту. Они присоединяют эту кислоту (при участии ферментов) к остатку глюкозы у 3-го углеродного атома (рис. 16). Присоединив, например, остаток паракумаровой кислоты, глюкозид кемпферола превращается в вещество, известное под названием тилирозида. Содержится оно в цветках липы (по-латыни "тилиа"). В лепестках петунии обнаружен петунозид ацилированный (при помощи остатка феруловой кислоты) дигликозид кемпферола.
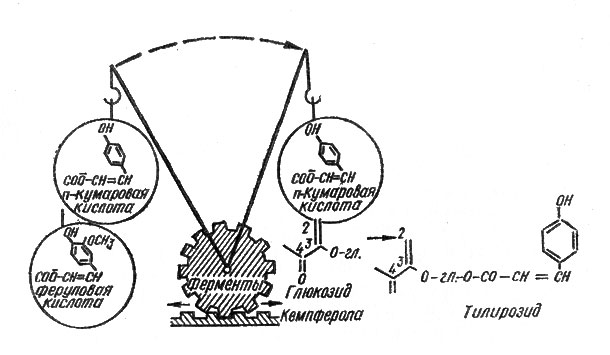
Рис. 16. Схема присоединения остатков оксикоричных кислот к молекулам флавоноловых гликозидов
Большое внимание физиологов и биохимиков растений в последнее время привлек ацилированный тригликозид кверцетина, который получил название кверцетин-гликозил-кумарата (КГК). Его выделили из гороха и описали свойства американские ученые Ф. Мамфорд, М. Фуруйя, А. Галстон, Б. Стоу, Д. Смит и Дж. Кэстл. Это было в начале 60-х гг. нашего века. О свойствах КГК и причине пристального к нему внимания мы скажем чуть ниже. Теперь лишь подчеркнем, что возможности для открытия все новых и новых флавоноловых гликозидов практически неограничены. В 1968 г. советские физиологи растений В. И. Кефели и P. X. Турецкая сообщили о весьма похожем на КГК соединении, которое они выделили из листьев салата.
Флавонолы и флавоны - поистине участок поля, далеко еще не полностью распаханного. Известный английский биохимик Дж. Харборн в своей книге "Сравнительная биохимия флавоноидов" (1967) подразделяет гликозиды одних только флавонолов на 48 классов, отмечая при этом, что число их еще не окончательно. Достаточно сказать, что эти соединения обнаружены в листьях свыше 70 % двудольных растений. В книге "Экстрактивные вещества древесины и их значение в целлюлозно-бумажном производстве" (1965), написанной группой крупнейших зарубежных специалистов, о флавонолах и флавонах говорится, что в растительном мире "более примечательным является их отсутствие, а не присутствие".
Нельзя не согласиться с этим, достаточно лишь вспомнить обилие золотисто-желтой пыльцы, вырабатываемой цветками и повсеместно распространяющейся в природе в таком количестве, что многие растения, как писал М. М. Пришвин, "пылят желтой мучницей".
На накопление флавонолов и флавонов в растениях оказывает влияние свет, его продолжительность и интенсивность.
Замечено, что свет необходим для образования всех флавоноидов, имеющих в положении 3 (см. рис. 1) группу ОН. Среди флавонолов этому условию соответствует кверцетин, среди флавонов - лютеолин.
Действительно, при освещении растений красным и дальним красным светом повышается содержание не только антоцианов (об этом уже говорилось выше), но и гликозидов кверцетина. На комплекс же гликозидов кемпферола действие света не распространяется. Считается, что гликозиды кемпферола, накопившись в темноте, способны превращаться (при участии фитохрома) в соответствующие гликозиды кверцетина (рис. 17).
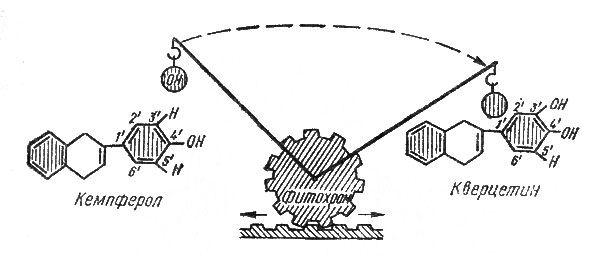
Рис. 17. Схема превращения гликозидов кемпферола в гликозиды кверцетина с участием фитохрома
Заметим, что система "кверцетин - кемпферол" очень часто обнаруживает свое присутствие в растительном мире. Вообще действие света на образование флавонолов и флавонов настолько специфично, что малейшая недостаточность в освещении растений резко отрицательно сказывается как на биосинтезе этих флавоноидов, так и на формировании тычинок. Так, у четырех видов кормового растения борщевика недостаток света приводил к очень слабому образованию флавоновых веществ в листьях и цветках и одновременно вызывал ряд нарушений в цветении (Д. Д. Басаргин, П. Г. Горовой, 1975). Образовавшиеся тычинки сразу же после распускания цветков опадали, а ряд соцветий (преимущественно боковых) вообще не получал развития.
Регулируется образование флавонолов и флавонов также и некоторыми другими факторами. Изучая вопросы накопления флавоновых веществ в зеленой массе горца забайкальского - перспективного для Белоруссии кормового растения, - мы обратили внимание на тот факт, что минеральное питание в дозе 30 и 60 кг/га азота, фосфора и калия положительно сказывается на концентрации этих веществ в стеблях и листьях в течение всего периода вегетации (И. А. Карабанов, Л. И. Булавко, 1975). Характерно, что в листьях их обнаруживается (в расчете на сухой вес) гораздо больше, чем в стеблях, и уровень этот поддерживается в течение всего лета, что является косвенным подтверждением установленного факта образования флавоноидов в процессе фотосинтеза.
Ранее мы говорили, что биосинтез флавоноидов ослабляется под действием азота, поскольку в растениях конкурируют за общий предшественник - аминокислоту фенилаланин - две системы: белкового и фенольного синтеза. В наших же опытах в период нарастания зеленой массы (а нарастает она у горца довольно быстро) минеральное питание усиливает образование флавоновых веществ как в листьях, так и в стеблях. Мы объясняем это эффективным использованием растениями основных элементов питания на сравнительно бедной ими дерново-подзолистой почве. Вместе с общей активизацией ростовых и других жизненно важных процессов (в том числе и синтеза белка) активизируются одновременно и те ферментные системы, которые принимают участие в формировании молекул флавоноидов. У. В. Маргна (1972) указывает, что эти системы имеют исключительно высокую работоспособность даже в самых неблагоприятных условиях (например, в условиях усиленного "захвата" фенилаланина для построения белковых молекул). Характерно, что в фазе цветения, когда особенно усиливается полифенольный обмен, под влиянием минерального питания в стеблях и листьях горца заметнее возрастат содержание наиболее окисленных флавоноидов - флавонолов, чем лейкоантоцианов.
Мы объясняем это усилением в растениях окислительных процессов благодаря преобладанию в почве ионов, способствующих реакциям окисления (O-3, Н2РО-4, Сl-) и внесенных туда вместе с содержащими их удобрениями - аммиачной селитрой, суперфосфатом и хлористым калием. Применение сбалансированного минерального питания, таким образом, дает возможность в какой-то мере сгладить конкурентные отношения между процессами биосинтеза белка и накоплением флавоновых веществ, обеспечить более высокий уровень их в зеленой массе ценного кормового растения.
Серьезная перестройка в комплексе флавоновых соединений и в фенольном обмене растений вообще происходит при обработке посевов гербицидами (от латинских "герба" - трава, "цедере" - убивать), т. е. веществами, уничтожающими сорную растительность. Обстоятельные исследования в этом направлении провел в Белоруссии А. П. Волынец вместе со своими сотрудниками и учениками (А. П. Волынец, 1974; Н. А. Ламан, 1970; С. М. Маштаков и др., 1971). Как же "ведут себя" флавонолы под влиянием химической прополки посевов?
В молодых растениях люпина и льна-долгунца под действием невысоких доз 2,4-Д, 2М-4Х (средства против двудольных сорняков) количество флавонолов возрастает в течение длительного отрезка времени. При этом активность роста растений в незначительной мере повышается. Иное действие оказывают более высокие дозы этих гербицидов, а также другие средства уничтожения сорной растительности в посевах - трихлоруксусная кислота (ТХА) и далапон. Не вдаваясь в ряд деталей множественного действия химических средств прополки посевов (что не входит в задачу нашего рассказа), отметим только, что высокие, "гербицидные" нормы указанных веществ вместе с уничтожением сорняков приводят к резкому нарушению фенольного состава культурных растений.
Особенно изменчивой оказалась группа флавонолов. Количество их в растительных органах уменьшается, при этом возрастает содержание более простых фенолов типа оксикоричных кислот (о которых речь шла уже выше), появляются новые фенолы, не свойственные растениям в обычных условиях. Характерно при этом, что количество широко распространенных в растительном мире ароматических аминокислот фенилаланина и тирозина, за "перехват" которых соревнуются биосинтез белка и биосинтез фенолов (рис. 4), уменьшается с одновременным подавлением белкового синтеза. В этом соревновании, таким образом, побеждают фенолы. Но какие и какой ценой? Ведь содержание флавонолов - этой обширной группы флавоноидов - уменьшается. Выходит, "пиррова победа"? Фенолы победили, но ценой флавонолов?
Оказывается, гербициды подавляют у культурных растений (более отчетливо - у чувствительных сортов, менее - у устойчивых) один из путей образования флавоноидов, а именно ацетатно-малонатный путь, который ведет к формированию кольца А их молекул. Одновременно усиливается деятельность второго - шикиматного - пути, благодаря которому формируется боковое кольцо Б (рис. 1). В результате такой внутренней перестройки путей биосинтеза фенольных соединений сложные молекулы флавоноидов (и в первую очередь - флавонолов) оказываются не в состоянии собрать свой "каркас", поскольку не хватает "строительного материала". Поэтому действие гербицидов и приводит к накоплению в культурных растениях более простых фенольных соединений, которые являются, как установлено, тормозителями роста. Их принято называть "фенольными ингибиторами" (от латинского "ингибире" - задерживать). Наиболее сильное ингибирующее действие на рост оказывают салициловая, паракумаровая и некоторые другие кислоты.
К фенольным ингибиторам роста относятся не только вещества с простейшей структурой молекул. В значительной мере тормозят ростовые процессы и некоторые флавоноиды, в частности флавонолы кверцетин и кемпферол. Их тормозящее действие четко прослеживается на работе хлоропластов - этих мельчайших клеточных органоидов, в которых происходит уникальный "космический" (по выражению К. А. Тимирязева) процесс использования солнечной энергии для окисления воды и восстановления углекислого газа в сложные органические вещества. А. П. Волынец и Р. А. Прохорчик (1973, 1978) определили, что если к выделенным из зеленого листа хлоропластам добавить незначительное количество кверцетина или его гликозида рутина, то отчетливо обнаруживается угнетающее действие этих веществ на нормальную работу хлоропластов. В чем оно заключается? Хлоропласт в введенными в него флавонолами медленнее и в меньшей мере выделяет кислород: флавонолы тормозят процесс разложения воды, протекающей в обычных условиях под действием поглощаемой солнечной энергии. Подсчитано, что деятельность хлоропластов подавляется наполовину. Присутствие в этих органоидах кверцетина ослабляет также процесс фотосинтетического фосфорилирования, т. е. образование при фотосинтезе веществ, богатых энергией.
По современным представлениям, фотосинтез - это беспрерывный поток электронов в зеленом листе от возбужденного светом хлорофилла через ряд промежуточных веществ-переносчиков на углекислый газ, который проникает в лист через микроскопические устьица-щели. Четкая и слаженная работа всех звеньев этой системы обеспечивает постоянство потока электронов. Нарушить его могут различные внутренние и внешние факторы. Накапливаясь в значительных количествах, флавонолы оттягивают на себя часть электронов, не давая возможности им нормально проходить по привычному пути, выработанному природой в течение многих лет. По данным Р. А. Прохорчик и А. П. Волынца, ингибирующая активность флавоноидов (и флавонолов в том числе) в этом отношении тем выше, чем больше в их молекулах групп ОН.
Таким образом, под действием флавонолов фотосинтез протекает менее продуктивно, что отрицательно сказывается на росте. Характерно, что видимому замедлению ростового процесса всегда предшествует накопление заметных количеств фенольных ингибиторов (в том числе и флавонолов). Хорошо это или вредно для растений?
Отметим, что деятельность ингибиторов роста - нормальное явление в мире растений. В жизни каждого растительного организма есть немало моментов, когда усиление ростового процесса нежелательно и даже вредно (например, осенью, при подготовке к зиме). В такое время и срабатывает система внутренней авторегуляции, в осуществлении которой принимают участие флавонолы и флавоны. Особенно сильным ингибиторным действием на рост обладает КГК - связанная с глюкозой форма кверцетина и паракумаровой кислоты. Об этом веществе мы уже говорили несколько выше. Подчеркнем сейчас, что именно благодаря своим ингибиторным свойствам оно и привлекает в последнее время внимание ученых. В системе внутренней авторегуляции ростового процесса КГК принадлежит важная роль. Замечено, что этот ацилированный флавонол образуется в клетках на самых ранних этапах роста. Его накопление продолжается по мере нарастания массы растительного организма и достигает максимума ко времени цветения. Другими словами, флавоноловый ингибитор функционирует во время самого активного роста. Не парадокс ли это? Что же он в таком случае ингибирует?
Оказывается, действие этого вещества носит сложный и своеобразный характер. Известно, что в растительном организме существует сложная система внутренней регуляции роста с помощью различных групп физиологически активных соединений: 1) гормональная (при участии растительных гормонов типа ауксинов, гиббереллинов, цитокининов, абсцизовой кислоты и этилена) и 2) негормональная (при участии витаминов, фенольных соединений и некоторых других веществ). О силе и направленности действия (ускорение или ослабление роста) того или иного регулирующего вещества судят обычно по прибавке в росте отрезков колеоптиле (первый лист, образующийся при прорастании злаков). Эти отрезки культивируют в растворе с добавлением изучаемого вещества в течение определенного времени. Таким способом в отношении КГК установили, что это вещество в дозе 2 мг и более на 1 л воды угнетает рост отрезков колеоптиле пшеницы на 40-50 % (Н. Н. Чумаковский, 1968). Паракумаровая кислота такое же действие оказывает, будучи испытанной в меньших дозах (0,5-1 мг на 1 л воды). Оба эти соединения снимают стимулирующее действие гиббереллинов - фитогормонов, сильно ускоряющих обычно рост стебля. Таким образом, и паракумаровая кислота, и КГК проявляют некоторое сходство в тормозящем влиянии на рост.
Однако в их "поведении" обнаружены и существенные различия: паракумаровая кислота ослабляет стимулирующее влияние на рост ауксинов, КГК же в присутствии этих фитогормонов не ослабляет рост, но даже проявляет с ними в какой-то мере синергизм, т. е. "помогает" им осуществлять стимуляцию ростового процесса. Почему? Дело в том, что КГК подавляет действие фермента ауксиноксидазы и тем самым предохраняет ауксины от окисления, которое осуществляется обычно с участием этого фермента. Вот почему ауксины в присутствии КГК увереннее "чувствуют себя" и более продуктивно выполняют свои функции по поддержанию и ускорению ростового процесса.
Так флавоноловый ингибитор КГК оказывается в роли не тормозителя, а ускорителя роста. Такое действие его усиливается еще и тем, что он "невольно" в какой-то мере выключает работу другого сильного ингибитора - паракумаровой кислоты. Ведь для образования его молекул эта кислота нужна как "строительный материал": совместно с кверцетином и глюкозой она связывается в единый комплекс - молекулу КГК. Характерно, что у карликовых форм гороха этот флавонол накапливается в больших количествах, чем у обычных (В. И. Кефели и др., 1973). Высокое его содержание обнаруживается в листьях гороха, салата при воздействии яркого света, тормозящего рост. Количество ауксинов при этом резко падает.
Флавонолам принадлежит важная роль в защите растений от болезней и вредителей. Выше мы говорили уже об опытах с пересадкой дубовой листовой филлоксеры на листья различных видов дуба. Фенольные соединения этого растения представлены в основном флавонолами. Вспомним, что название одного из них, наиболее распространенного, - кверцетина происходит от латинского наименования дуба (кверкус). В естественных условиях не все виды дуба поражаются филлоксерой. Этот вредитель не приживается, например, на листьях дуба северного, черешчатого и двуцветного.
Как же реагируют устойчивые виды этого дерева на искусственную подсадку к ним яиц и личинок листовой филлоксеры?
Дуб северный сразу же "не принял" вредителя, дуб черешчатый "терпел" его только в течение двух недель, а затем отверг. На дубе двуцветном филлоксера вначале прижилась и была отторгнута лишь через некоторое время. Таким образом, ни один из этих видов дуба "не принял" вредителя. В обычных условиях, когда эти виды дуба живут без вредителя, в их листьях содержится сравнительно небольшое количество флавонолов. Не исключено, что они вовлекаются в общий обмен веществ и помогают поддерживать жизненный тонус организма на более высоком уровне. С подсадкой вредителя содержание флавонолов в листовых тканях возрастает: растения мгновенно создают какой-то барьер на пути филлоксеры.
Возможно, что это явление и не служит еще доказательством защитного действия флавонолов от филлоксеры, однако наличие какой-то связи между накоплением в клетках этих соединений и отторжением вредителя несомненно.
Любопытные сведения о защитной роли флавонолов и флавонов получены в Институте биоорганической химии АН СССР (Г. П. Кононенко и др., 1975; С. А. Поправко, 1976). Из зимующих почек березы бородавчатой было выделено несколько флавонолов и флавонов, которые способны подавлять рост колеоптиле пшеницы, т. е. являются фенольными ингибиторами. Накапливаясь обычно ко времени наступления зимы, они обеспечивают задержку ростовых процессов и переход деревьев в состояние покоя.
Но вот наступает весна, и березовые почки оживают. Кто бывал в это время в березовой роще, тот не мог не наблюдать выпадение на землю смолисто-янтарных капелек, слегка липких и сладковато-терпких на вкус. Пронизанные солнечными лучами, литые, сверкающие, выкатываются они из распускающихся почек мелкими слезинками. Березы "плачут".
Явление это известно людям давно, но только теперь выяснилось, что в березовых "слезах" и почках находятся те же флавонолы и флавоны, что и в пчелином клее - прополисе (от греческих "про" - раньше, перед, "полис" - город), при помощи которого эти удивительные насекомые прикрепляют восковые крышечки, закрывающие вход в их "город"-соты. Характерно, что и в березовых почках, и в прополисе флановолы и флавоны содержатся примерно в одинаковых соотношениях: об этом, по-видимому, позаботились пчелы - эти неутомимые труженики природы. Прополис обладает чудесными бактерицидными свойствами: в летний зной, когда для развития бактерий наступают самые благоприятные условия, пчелиный улей представляет собой эталон стерильной чистоты. От проникновения туда микробов он надежно защищен природными флавонолами, флавонами и другими близкородственными веществами, содержащимися в прополисе. Подсчитано, что до 150 г из одного улья собирают пчеловоды полезного человеку клея за сезон, и в каждом его грамме содержатся березовые "слезы", обладающие целебными свойствами.
Поистине неисчерпаема кладовая природы! Не зря любители русской бани предпочитают березовый веник всем другим, особенно при ощутимой ломоте в пояснице, насморке, кашле: флавонолы и флавоны его листьев совместно с другими Р-активными веществами и щедрым жаром парилки укрепляют стенки кровеносных сосудов, оказывают благотворное действие па кровообращение организма, возвращают человеку бодрость и здоровье.
Выше мы уже упоминали о "содружестве" всем известного витамина С (аскорбиновой кислоты) и лейкоантоцианов, которые предохраняют его от окисления и потери витаминных качеств. Выяснилось, что подобными свойствами обладают и флавонолы.
Впервые о взаимосвязанном влиянии витамина С и Р-активных флавоноидов на организм человека и животных сообщили еще в 1938 г. венгерские биохимики А. Сцент-Дьердьи и Л. Висбери. Позже были получены данные о стабилизирующем действии некоторых флавоноидов (в том числе флавонолов и флавонов) на аскорбиновую кислоту и в растительных организмах. Удобным объектом изучения этого их свойства явилась черная смородина, известная как хороший С-витаминоноситель.
Г. Б. Самородова-Бианки (1965) проследила за накоплением витамина С и флавонолов в ягодах ряда сортов этого растения. Что же выяснилось? По мере роста и созревания ягод увеличение абсолютного количества аскорбиновой кислоты в них сопровождается энергичным накоплением флавонолов: кверцетина, кемпферола, мирицетина. Особенно благоприятным сочетанием этих веществ отличаются сорта европейского подвида черной смородины (100 мг % флавонолов и 190 мг % витамина С).
На чем же основано такое "содружество" флавонолов и этого известного витамина? Оказывается, опять-таки... на ингибиторных свойствах флавонолов: они ослабляют работу фермента аскорбиноксидазы, который обычно ускоряет окисление витамина С. Наиболее сильным "укрощающим" действием на этот фермент обладает кверцетин (Г. Б. Самородова-Бианки, Г. Стенлид, 1968). Механизм такого действия флавонолов объясняется способностью их образовывать комплексные соединения с ионами металлов, в частности с медью, а также защитным действием флавонолов. Медь входит составной частью в активный центр фермента аскорбиноксидазы. Связываясь через нее как через своеобразный "мостик" в единый комплекс с ферментом, флавонолы "отключают" его от активной работы по окислению витамина. Так по цепочке прослеживаются истоки взаимодействия флавонолов и широко распространенного в растительном мире витамина С, взаимодействия, в основе которого лежат антиокислительные (антиоксидантные) свойства флавонолов. На этих свойствах основано современное практическое использование этих флавоноидов (особенно их агликонов) в пищевой (плодоконсервной) промышленности для предохранения продуктов (в том числе и продуктов консервирования) от окисления, чем дольше сохраняется их качество. Флавонолы нашли практическое использование (совместно с катехинами и другими флавоноидами) в стабилизации пищевых жиров, в консервировании гранатов, яблок, винограда, груш, красной смородины, черники, голубики. Совместно с антоцианами флавоны и флавонолы используются в качестве красящих веществ в кондитерской промышленности.
Какие же растения являются наиболее богатыми по содержанию биологически активных флавонолов и флавонов - этого большого семейства фенольных соединений, которые присутствуют практически во всех частях растительного организма? Прежде чем говорить о природных источниках флавонолов и флавонов, отметим, что наибольшую популярность из этих веществ получил кверцетин и один из его гликозидов - рутин. Таблетки их можно приобрести сейчас в любой аптеке. Все они растительного происхождения, главным образом - из листьев гречихи. Впервые рутин был получен из этого растения еще в 1944 г. в США. М. Ф. Шахова (1959) указывает, что лучшими сортами гречихи по содержанию рутина являются Богатырь, Большевик, Красноуфимская и Епифанская (до 2880 мг % в расчете на сухой вес).
Сравнивая районированный в Белоруссии сорт гречихи Юбилейная 2 и близкородственное растение горец забайкальский по содержанию в их листьях флавоновых соединений (в расчете на рутин), мы обнаружили, что горец в этом отношении выгодно отличается от гречихи. Если листья гречихи (при выращивании ее в окрестности г. Гомеля) накапливают ко времени цветения 160 мг % этих веществ (в расчете на сырой вес), то листья горца - 300-321 мг % (И. А. Карабанов, Л. И. Булавко, 1975). Применение полного минерального питания в посевах по 30 и 60 кг/га азота, фосфора и калия позволяет повысить содержание флавоновых соединений в листьях горца до 420-540 мг % (в зависимости от условий года). Горец забайкальский на дерново-подзолистой супесчаной почве образует довольно высокий сомкнутый травостой, поэтому зеленая масса его с единицы площади дает гораздо больший выход флавоновых веществ, чем гречиха.
В качестве хорошего источника рутина зарекомендовала себя софора японская. Это бобовое древесное растение с большой развесистой кроной, хорошо известное в Японии, Китае, Корее. В нашей стране софору японскую используют для озеленения городов в южных районах (Ростовская область РСФСР, Украина, Молдавия и др.). Вот как описывает это дерево профессор С. И. Ивченко в своей "Книге о деревьях" (1973): "Внешне софора напоминает белую акацию и очень привлекательна, когда ее крона сплошь покрыта душистыми кремоватыми цветками. Цветки-мотыльки появляются на дереве дружно и недели через две так же дружно опадают, сплошь устилая землю. Их место занимают длинные клейкие зеленые плоды - бобы с небольшими, будто зерна мелкой фасоли, семенами".
В лепестках, цветочных бутонах, а также бобах софоры сконцентрировано громадное количество флавонолов и флавонов. Не зря наши предки издавна добывали из цветочных бутонов софоры японской стойкий желтый краситель. По данным М. Ф. Шаховой (1959), бобы софоры накапливают до 44000 мг % флавоновых веществ (в расчете на сухой вес). Примерно в два раза меньше обнаружено их в листьях эвкалипта.
И софора, и эвкалипт - эти рекордсмены по накоплению флавоновых соединений - теплолюбивые растения. А. В. Благовещенский (1966) отмечает, что наиболее богата флавоноловыми гликозидами растительность тропических и альпийских природных зон. Он объясняет такую приуроченность этих веществ важной ролью их как поглотителей ультрафиолетовой радиации, благодаря чему хлорофилл и цитоплазма клеток предохраняются от перегрева и разрушения. У эвкалипта, как известно, есть еще одно природное приспособление к предотвращению перегрева: его листья ориентированы по отношению к солнцу ребром своих пластинок, благодаря чему и флавоновые вещества, и хлорофилл их в наименьшей мере подвержены разрушению. Поэтому эвкалиптовое дерево и не дает тени: природа мудро распорядилась его достоинствами, отдав предпочтение целебным качествам эвкалиптового листа, а не роли его в создании тенистых мест под палящими лучами южного солнца.
Гликозидами кверцетина весьма богаты лепестки и семена хорошо известного своей декоративностью конского каштана обыкновенного. Невозможно не любоваться величавыми розовато-белыми с легкой желтизной свечами соцветий этого дерева! Красавцы-каштаны украшают улицы Москвы и Ужгорода, Гомеля и Одессы, Мозыря и Кишинева. Цветущая ветвь этого обильного своей зеленью растения заняла центральное место в гербе г. Киева. Но ценность каштана не только в его декоративной красоте. Созревшие его светло-коричневые семена, а также сухие листья, содержащие кверцетин, связанный с остатками глюкозы, арабинозы, рамнозы и других сахаров, экспортируются в зарубежные страны.
Богаты флавоновыми веществами сибирские и дальневосточные виды лекарственного растения володушки. Обстоятельные исследования в этом направлении проведены В. Г. Минаевой с сотрудниками (В. Г. Минаева, 1978). В результате этой работы выяснено, что листья, стебли и соцветия володушки накапливают кверцетин, изорамнетин, а также их гликозиды: изокверцитрин, рутин и изорамнетин-3-рутинозид. Последний особенно концентрируется в генеративных органах. В тычинках его содержание составляет около 74 %, в завязях пестиков достигает 85 % от общего количества флавонолов. Больше всего содержится флавонолов в соцветиях и листьях володушки - до 9352 мг % в расчете на абсолютно сухой вес.
Обилие флавоновых веществ в различных видах володушки послужило основанием для выделения из нее суммарного препарата этих флавоноидов, который был назван буплерином (от латинского названия володушки "буплеурум"), а его авторы В. Г. Минаева, К. А. Соболевская, Т. А. Волхонская, М. П. Малых и И. В. Ашихмина получили авторское свидетельство на изобретение (В. Г. Минаева, 1978).
Буплерин содержит в себе пять флавоноловых соединений, из которых 70 % (по весу) принадлежит изорамнетин-3-рутинозиду и около 25 % - рутину. Он испытывался в четырех клиниках страны (МГМИ имени Н. П. Пирогова, Глазная клиника Северо-Осетинского мединститута, Клиника глазных болезней имени В. П. Одинцова МГМИ имени И. М. Сеченова, кафедра детских болезней Новосибирского мединститута), в результате чего доказано, что препарат уменьшает проницаемость кровеносных капилляров при лечении сердечно-сосудистых заболеваний, снижает отек тканей сетчатки глаза, благоприятно действует при первичных атаках ревматизма, при острой пневмонии и остром нефрите у детей. Действие буплерина выражено сильнее при совместном применении его с витамином С. Эффективность препарата особенно проявилась при глазных операциях, где он в значительной мере уменьшает кровоизлияние как во время операции, так и в послеоперационный период.
Выше мы уже говорили о чайном растении и его катехинах, отмечали, что Р-витаминный комплекс его состоит не только из катехинов. В состав фенольных соединений чайного листа входят также гликозиды кемпферола, кверцетина и мирицетина. Характерной особенностью их, как указывают М. А. Бокучава с сотрудниками (1968), является высокая устойчивость к разрушению в процессе производства черного чая: около 80 % флавонолов, содержащихся в зеленом чайном листе, сохраняется в готовом продукте - черном байховом чае.
Флавоны апигенин и лютеолин в обильном количестве обнаруживаются совместно с кверцетином и его производными в растениях семейства сложноцветных, в частности в соцветиях и листьях пижмы обыкновенной (П. П. Хворост, 1968), в различных видах астрагала (австралийский, пушистоцветковый, новоасканийский, шерстистоцветковый), а также хорошо известной всем ряски, заполняющей своими маленькими листочками поверхность стоячих водоемов (П. Е. Кривенчук и др., 1968). Флавон трицин накапливается в листьях хлебных злаков (особенно в пшенице), в стеблях и листьях различных видов комнатного растения примулы (Дж. Харборн, Н. Симмондс, 1968).
Среди кормовых растений пойменного травостоя, по нашим исследованиям, накоплением флавоновых веществ выделяются (в расчете на сухой вес) овсяница луговая (300 мг %), полевица собачья (176 мг %), мятлик луговой и манник водяной (154 мг %). На втором месте по накоплению этих флавоноидов в зеленой массе стоят вейник длинный и тимофеевка луговая (до 114 мг %), на третьем - вейник наземный (98 мг %) и лисохвост луговой (80 мг %).
Высоким содержанием флавонолов и флавонов характеризуются многие плодово-ягодные растения. По данным Д. К. Шапиро с сотрудниками (1961), ягоды черной смородины, богатые антоцианами, содержат много и флавоновых веществ. Это в первую очередь такие сорта и гибриды ее, как Лошицкая (до 178 мг %), 4/9-Д (до 192 мг %) и 4/39 (до 220 мг %). Из косточковых пород по содержанию этих веществ выделяются плоды вишни сортов Гриот остгеймский (до 1105 мг %), Владимирская и Новодворская (до 192 мг %). По исследованиям лаборатории химии растений ЦБС АН БССР, много флавоновых веществ накапливается в мякоти плодов пятипестичного, алмаатинского, зеленомясного и колючего боярышников. Следует отметить, что плоды боярышников характеризуются высоким количеством и большим разнообразием флавонолов и флавонов в плодах. Большинство видов его содержит в расчете на сухой вес 200-330 мг % флавоновых веществ в плодах, а у таких сортов, как Приречный и Вееровидный, эти цифры достигают соответственно 665 и 623 мг % (В. П. Петрова, 1968). Наибольшее количество флавоновых соединений оказалось в мякоти плодов боярышника согнуточашечкового. В. С. Батюк и Д. Г. Колесников (1968) весь комплекс этих веществ разделили на 4 группы: кверцетина (гиперозид, кверцитрин, кверцетин), лютеолина (глюколютеолин), апигенина (космосиин, рамноапигенин) и группу С-гликозидов (кратенацин, дезацетилкратенацин).
Характеризуя эти данные, Л. И. Вигоров во вступительном докладе на IV Всесоюзном семинаре по биоактивным веществам плодов и ягод (г. Мичуринск, 1970 г.) с озабоченностью подчеркивал настоятельную необходимость фармакологических исследований крупноплодных и вкусных боярышников, таких, как холмовой, понтийский, Пояркова, Бреттшнейдера и другие, по их влиянию на сердечную деятельность. Он предсказывал, что близкие по качественному составу флавоновые вещества должны быть обнаружены в айве, груше и рябине.
В плодиках рябины обыкновенной содержится достаточно высокое количество флавоновых веществ - 246 мг % в расчете на сырой вес (А. А. Чаховский и др., 1976).
Словом, природная аптека из различных представителей большого семейства флавонолов и флавонов всюду окружает нас. Они не всегда так отчетливо видны, эти желтые флавоноиды, как это имеет место в лепестках анютиных глазок, плодах рябины или вокруг высохших весенних лужиц, где образуются золотистые обрамления из сбитой дождем пыльцы.
Но сопутствуют человеку флавонолы и флавоны повсеместно - в листьях, стеблях, цветках, плодах самых различных растений. Природа немыслима без этой желтой аптеки.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'