
1.6. Роль мембран в устойчивости
В настоящее время большое внимание привлечено к исследованию регуляторной роли мембран в клеточном метаболизме, в частности, в адаптации растительных организмов к факторам внешней среды. Характерной чертой внутриклеточных мембран является их способность к структурным переходам, которые, по мнению ряда авторов, играют роль триггерного механизма в переключении клетки из одного метаболического состояния в другое [24; 6].
Имеющиеся в литературе данные позволяют рассматривать мембрану как двойной модификатор передачи информации от сигнального вещества в клетку. С одной стороны, состояние мембраны определяет активность и чувствительность рецепторов к действию экзогенных и эндогенных факторов; с другой - структурная подвижность мембраны определяет эффективность перестройки клеточного метаболизма в ответ на связывание сигнального вещества.
Основным свойством мембран является возможность взаимодействия в их матриксе липидных и белковых компонентов. Согласно одной из наиболее приемлемых моделей мембраны, модели жидкостно-мозаичного кристалла, липиды представляют собой матрикс, на котором зафиксированы белковые молекулы. Модификация липидной фазы может достигаться декарбоксилированием, метилированием, удалением или заменой гидрофильных головок фосфолипидов и экранизацией их заряда, например, с помощью ионов кальция.
В составе мембран имеются различные белки, выполняющие функции ферментов, насосов, переносчиков, рецепторов, ионных каналов, и структурные белки. Липидные компоненты оказывают влияние на мембранносвязанные белки-ферменты через прямое участие в работе активного центра, а также опосредованно через воздействие на другие участки молекулы белка. Кроме того, они могут изменять положение белка в мембране. Белки, в свою очередь, оказывают воздействие на состояние липидов. Так, в тилакоидах хлоропластов содержится липоксигеназа, активация которой вызывает глубокие изменения липидов.
Мембрана - структура динамичная, что обеспечивается вязкостью ее липидного компонента, его текучестью. Липиды мембраны могут находиться в двух состояниях - жидкого кристалла или геля. При определенных условиях возможен переход из одного фазового состояния в другое. Фазовые переходы в основном определяются структурными характеристиками жирно-кислотных цепочек: их длиной, степенью насыщенности жирных кислот, уровнем ионизации полярных головок групп, определяющих плотность поверхностного заряда.
По данным Д. Грина и Р. Гольдбергера, липиды составляют не менее 30% сухого вещества мембран [14]. Практически все мембраны независимо от их происхождения содержат фосфолипиды, содержание которых составляет от 40 до 90% общего количества липидов в мембране. Фосфолипиды выполняют в мембране структурную роль, способствуют стабилизации активной конформации ферментов, создают гидрофобную среду, что необходимо для взаимодействия фермента с субстратом, определяют осмотические свойства внутриклеточных структур и полупроницаемость мембран. Галактолипиды - основные компоненты мембран хлоропластов (61% от всех липидов) - принимают, по-видимому, участие в процессах транспорта воды и ассимилятов через хлоропластные мембраны. Сульфолипиды - серусодержащие липиды - обнаружены в мембранах растений (хлоропласты, плазмалемма) и животных. Полагают, что данные липиды являются сильными анионами и создают молекулярную основу для поляризации мембран. Для плазмалеммы характерно высокое отношение стеринов к фосфолипидам (0,82 - 0,92).
Количественное соотношение липидных фракций (фосфо-, сульфо- и галактолипидов) определяет стабильность клеточных мембран и их устойчивость. Показано, что при стрессовых воздействиях и холодовом закаливании наблюдается увеличение содержания фосфолипидов (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилглицерин) и минорных фосфолипидов (фосфатидилинозит, фосфатидная кислота, дифосфатидилглицерин). Содержание галактолипидов сохраняется почти неизменным у устойчивых и среднеустойчивых растений и несколько понижается у неустойчивых.
Для устойчивости важно не только соотношение между данными липидами, но и их жирно-кислотный состав. В составе липидов имеются насыщенные и ненасыщенные жирные кислоты, которые различаются по своей конфигурации (табл. 3).

Таблица 3. Состав и температура плавления наиболее распространенных жирных кислот
Среди насыщенных жирных кислот, наряду с небольшими количествами миристиновой и стеариновой, главное место у растений занимает пальмитиновая кислота. В частности, в этиолированных и зеленых проростках пшеницы содержание миристиновой, лауриновой и стеариновой кислоты колеблется от 10 до 80 мкг/г сырого веса. Существенно выше доля пальмитиновой кислоты (около 1 мг/г сырого веса). Насыщенные жирные кислоты имеют в углеводородной части молекулы жесткий изгиб и структурные перестройки у них ограничены. При увеличении в липидном компоненте доли насыщенных, более тугоплавких жирных кислот обнаруживается избыточная структуризация мембран.
У высших растений возможен переход насыщенных жирных в ненасыщенную форму. Обнаружены десатурирующие ферменты, которые связаны с эндоплазматическим ретикулумом и действие которых зависит от присутствия кислорода. Скорость синтеза десатурирующего фермента строго зависит от температуры. Синтез его индуцируется при снижении температуры. При повышении температуры как синтез, так и активность десатурирующего белка резко снижается, а при 34°С фермент обратимо инактивируется. Данные белки при низких температуpax осуществляют превращение насыщенных жирных кислот в цисненасыщенные формы. Увеличение процента ненасыщенных жирных кислот при снижении температуры среды установлено для большинства растительных объектов.
Из ненасыщенных жирных кислот у растений преобладает линолевая. В ненасыщенных жирных кислотах (олеиновая, линоленовая и др.) углеводородная часть молекулы может существовать в виде бесконечного числа конформаций благодаря тому, что каждая связь углеродного скелета молекулы имеет полную свободу вращения. Появление двойной связи в жирной кислоте определяет повышение текучести мембран, их динамичности.
По В. Я. Александрову изменение соотношения ненасыщенных к насыщенным жирным кислотам в мембранах может достигаться различными путями: изменением скорости синтеза и распада кислот с разным содержанием ненасыщенных двойных связей; изменением подбора жирных кислот, включаемых в мембрану; различной активностью десатурирующих ферментов, катализирующих образование двойных связей.
В настоящее время доказано, что клетки растений, животных и микроорганизмов обладают способностью адаптивно изменять состав жирных кислот в липидах, а также соотношение липидных фракций в ответ на повышение или снижение температуры среды.
Гибкость и эластичность мембран определяется составом, количеством ненасыщенных жирных кислот и наличием в них белков, обладающих высокой степенью подвижности (актомиозинподобные белки типа АТФазных белков). Благодаря высокой подвижности и эластичности мембраны сохраняют способность к обратимому сокращению и набуханию в широком диапазоне действующего фактора. Для функционирования ферментных систем, работы рецепторов в клеточных мембранах и для проницаемости мембран существенное значение имеет уровень подвижности углеводородных цепей жирных кислот в липидах. Снижение или повышение температуры по отношению к зоне оптимума соответственно приводит к избыточному "затвердению" или "разжижению" жирных кислот. Клетки растений, животных и микроорганизмов обладают способностью адаптивно изменять состав жирных кислот в липидах, а также соотношение липидных фракций в ответ на действие экстремальных факторов среды, в частности, на снижение или повышение температуры. При температуре ниже оптимума происходит повышение процентного содержания ненасыщенных жирных кислот. При повышении температуры сверх оптимальной увеличивается доля насыщенных, более "тугоплавких" жирных кислот. Следовательно, избыточная структуризация или избыточное разжижение жирных кислот в некоторых случаях может определять устойчивость организмов и клеток к действию холода или нагрева. В связи с этим при закаливании и адаптации растительных и животных организмов к холоду жирнокислотный состав липидов становится менее насыщенным, о чем свидетельствуют увеличение отношения суммы ненасыщенных жирных кислот к насыщенным, индекса двойных связей и отношения кислот линоленового к кислотам линолевого ряда.
Таким образом, умение приспосабливать состав липидов к температуре среды - одно из самых ярких проявлений удивительной адаптивной способности клеток.
При действии экстремальных факторов среды могут происходить существенные нарушения в структуре и функциональной активности клеточных мембран. Одним из механизмов их повреждения являются процессы свободнорадикального окисления их компонентов.
Молекулярный кислород малотоксичен для аэробных организмов, гораздо более серьезную опасность представляют продукты его неполного восстановления: супероксидный радикал (O 2), перекись водорода (H2O2), гидроксильный радикал (.OH), синглетный кислород (1O2) и др.
2), перекись водорода (H2O2), гидроксильный радикал (.OH), синглетный кислород (1O2) и др.
Образование супероксидного радикала является результатом одноэлектронного восстановления молекулярного кислорода: O2+e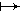 O
O 2. При двухэлектронном восстановлении молекулярного кислорода образуется перекись водорода: O2+2e+2H+
2. При двухэлектронном восстановлении молекулярного кислорода образуется перекись водорода: O2+2e+2H+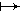 H2O2. Известно, что супероксидный радикал и перекись водорода по отдельности малотоксичны, но при взаимодействии способны генерировать сильные окислители - .OH и, возможно, 1O2.
H2O2. Известно, что супероксидный радикал и перекись водорода по отдельности малотоксичны, но при взаимодействии способны генерировать сильные окислители - .OH и, возможно, 1O2.
Термин "активные формы кислорода" обозначает совокупность короткоживущих, взаимопревращающихся и реакционноспособных форм кислорода, возникающих в результате его электронного возбуждения или окислительно-восстановительных превращений.
Некоторые, окислительно-восстановительные ферменты, в частности мембранно-связанные флавиновые дегидрогеназы, НАДФН-оксидазы, активно продуцируют супероксидный анион. Эффективными фотосенсибилизаторами генерации сенглетного кислорода являются хлорофиллы, другие порфирины, а также флавины. Образование кислородных радикалов и синглетного кислорода происходит в связи с липоксигеназной реакцией. Липоксигеназы - класс ферментов, катализирующих образование гидроперекисей из полиненасыщенных липидов. Образующиеся гидроперекиси, обладая весьма высокой окислительной способностью, могут окислять другие ненасыщенные жирные кислоты, а также каротиноиды, аминокислоты, хлорофиллы и др.
Активация свободнорадикальных окислительных процессов происходит в митохондриях при окислении ряда субстратов и в большей степени связана с цианидустойчивым дыханием, в хлоропластах при нарушении фотосинтетической электронтранспортной цепи, а также в плазматических мембранах и в клеточной стенке при иммунном ответе клетки.
При взаимодействии супероксидного аниона с ненасыщенными жирными кислотами образуются липидные перекиси, с гетероциклами - эндонерекиси. Синглетный кислород окисляет соединения, в состав которых входит сера, азот. Например, метионин окисляется до сульфоксида. Все эти продукты токсичны для растительной клетки.
В настоящее время установлено, что 1O2 играет важную роль в процессах фотосенсибилизированного окисления полисахаридов, стероидов, НАДН, НАДФН. Взаимодействия форм активированного кислорода с липидами и пигментами во многом определяют степень повреждения мембран растительных клеток. В мембранах процессы перекисного окисления липидов под влиянием активированного кислорода приводят к разрешению полиненасыщенных жирных кислот. Результатом изменений соотношений между ненасыщенными и насыщенными жирными кислотами могут быть нарушения таких важных мембранных свойств, как проницаемость, текучесть, способность к латеральной диффузии, "флипфлопу", а это в свою очередь вызывает отклонения в функционировании мембранно-связанных ферментов.
В настоящее время накоплен обширный экспериментальный материал, свидетельствующий о важной роли окислительных реакций в мембранах растений при самых различных воздействиях (света, температуры, дефицита влаги, патогена и др.). Полагают, что во многих стрессовых ситуациях окислительные процессы в мембранах являются первопричиной или развиваются на относительно ранних этапах патологического процесса.
Показано, что при освещении растительных клеток светом высокой интенсивности (103Вт/м2) происходит накопление перекисей липидов, необратимое ингибирование первичных реакций фотосинтеза и гибель клеток.
Под влиянием низкой температуры наблюдается окислительная деградация полиненасыщенных жирных кислот, хлорофиллов и накопление малонового диальдегида - продукта перекисного окисления липидов. В частности, в корнях растений костра безостого неустойчивого сорта ВИР-5, произрастающих в Мурманской области, к концу зимы снижается содержание линоленовой кислоты и значительно возрастает содержание малонового диальдегида. В тканях более устойчивого сорта подобных изменений обнаружено не было. Повреждения чувствительных к низким температурам растений могут быть связаны с накоплением в тканях H2O2 в результате ингибирования каталазы. Перекись водорода в этом случае может рассматриваться как источник повреждающих кислородных радикалов.
Деградация структуры хлоропластов у чувствительных к водному стрессу растений происходит в результате активации перекисного окисления липидов. В частности, в работах М. Н. Мерзляка показано, что у чувствительного к водному стрессу сорта пшеницы Лютесценс 1848 под влиянием засухи происходит увеличение выхода электролитов из листьев, снижение содержания линоленовой кислоты в хлоропластах и увеличение содержания малонового диальдегида в тканях. Эти изменения при достаточных значениях водного дефицита не были выявлены у устойчивого сорта пшеницы Саратовская 55 [33].
При заражении растений происходит активация перекисного окисления липидов в клетках растения-хозяина, что вызывает быструю гибель этих клеток (реакция сверхчувствительности), в результате чего достигается локализация патогена, что ограничивает проникновение его в живые ткани.
Устойчивость растений к различным воздействиям окружающей среды в значительной степени зависит от состояния систем детоксикации форм активированного кислорода. Обезвреживание свободных радикалов и синглетного кислорода осуществляется следующими ферментами: супероксиддисмутазой (СОД), каталазой и пероксидазой. СОД - основной фермент, вызывающий элиминацию супероксидных анион-радикалов и снижающий их концентрацию в 104 раз. Фермент катализирует следующую реакцию:
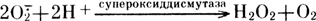
Супероксиддисмутаза обнаружена практически во всех тканях высших растений, у некоторых видов голосеменных, мхов, водорослей и др. Активность данного фермента выявлена в цитозоле, митохондриях, пероксисомах и хлоропластах. В ряде случаев отмечается корреляция между активностью супероксиддисмутазы и устойчивостью растительных клеток к фотоповреждению.
Каталаза и пероксидазы выполняют защитные функции, препятствуя накоплению перекисей, оказывающих повреждающее действие на клеточные компоненты. Каталаза в пероксисомах активно разлагает перекись водорода с образованием воды и молекулярного кислорода:
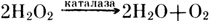
В хлоропластах высших растений отсутствует каталаза, и разрушение H2O2 осуществляется сопряженной системой, основным компонентом которой является аскарбатпероксидаза.
Важными антиоксидантами являются α-токоферол (витамин E), аскорбиновая кислота (витамин C) и каротиноиды, которые в присутствии супероксиддисмутазы предотвращают выцветание пигментов и пере- окисление липидов. Водорастворимая аскорбиновая кислота и жирорастворимый α-токоферол имеют слабые O - H связи и поэтому выступают в роли активных ловушек свободных радикалов соответственно в водном растворе и липидной фазе. В настоящее время рассматривается роль α-токоферола как ингибитора липидных свободных радикалов и тушителя синглетного кислорода. Основная функция этого витамина заключается в стабилизации структурно-функциональных свойств биологических мембран.
Каротиноиды благодаря своей относительной стабильности могут выступать в качестве защитных пигментов, предохраняя светочувствительные хлорофиллы от фотоокислительных разрушений. Молекулы хлорофилла при избытке света переходят в триплетное состояние, что способствует образованию синглетных форм кислорода, которые вызывают процессы необратимого окисления пигментов и жирных кислот. Каротиноиды реагируют с хлорофиллом, находящимся в триплетном состоянии, переводят его энергию в теплоту и гасят синглетные формы кислорода.
Следовательно, в растительных организмах мощная антиокислительная система, включающая антиоксидативные ферменты, обеспечивает защиту важнейших компонентов клетки в широком диапазоне действия факторов среды. Системы, обеспечивающие как генерацию, так и детоксикацию форм активированного кислорода, обладают высокой пластичностью. В частности, под влиянием экстремальных факторов окружающей среды избыточная продукция супероскидных анионов может индуцировать повышение активности супероксиддисмутазы.
Таким образом, "устойчивость мембран растительных клеток к действию повреждающих факторов обусловлена составом, структурой и свойствами их белковых и липидных компонентов, а также наличием систем, детоксицирующих кислородные радикалы, тушителей синглетного кислорода и перехватчиков свободных радикалов."
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'