
Значение физиологии для садоводства
Обрезка
Обрезка - один из старейших садоводческих приемов, используемых человеком для улучшения эстетических свойств и оптимизации продуктивности деревьев и кустарников. Он состоит в избирательном удалении некоторых ветвей с целью изменить тип роста. Удаление мертвой, больной или поврежденной древесины помогает сохранять растения здоровыми, устраняя возможные источники общего заражения. Если из ландшафтных соображений желательны кустарники или деревья определенной формы, эту форму можно создать путем обрезки ветвей, не соответствующих нужному типу. Обрезку можно также использовать для улучшения качества, а иногда и количества образующихся цветков или плодов. Общее прореживание благоприятствует проникновению в крону света и воздуха, увеличивая число листьев с оптимальной интенсивностью фотосинтеза; при избирательном прореживании удаляются слабые ветви, что усиливает рост остальных благодаря большей доступности для них воды и питательных веществ. Хотя обрезка и тормозит общий рост, уменьшая общее число листьев, оставшиеся ветви растут более энергично и продуктивно. Общеизвестным примером пользы от обрезки могут служить розы: если удалять у них слабые боковые побеги, а сильные подрезать, оставляя лишь одну или две здоровые почки, из этих почек вырастают мощные ветви с крупными цветками.
При удалении конца побега число ветвей увеличивается. Это связано главным образом с тем, что устранение источника ауксина (апикальной почки) нарушает апикальное доминирование в данной ветви и в результате боковые почки прорастают (см. гл. 9). Этот прием используется для создания более компактной кроны и может содействовать формированию плодов у таких деревьев, как яблоня, у которых плоды образуются на коротких боковых шпорах. Таким образом, обрезка перераспределяет ресурсы растения для получения желательной формы или продукта вместо беспорядочного и более слабого вегетативного роста.
Ювенильность
Растения, слишком молодые для образования цветков и плодов, называются ювенильными. Продолжительная ювенильность древесных растений часто создает экономическую проблему. Она определяет время, в течение которого плодовое дерево должно расти, чтобы дать урожай. Ювенильность важна и для лесоводов, поскольку она препятствует раннему образованию семян на мощных хвойных деревьях. Иногда листья у ювенильных деревьев (например, у Eucalyptus) отличаются по форме от листьев взрослого дерева. У других растений (например, цитрусовых) в ювенильный период могут быть колючки, а у взрослой формы их нет. Наконец, у третьих ювенильные черенки легко укореняются, а черенки взрослых форм не укореняются вовсе. В некоторых случаях ювенильность рассматривают с точки зрения садоводства как преимущество; например, ювенильная листва можжевельника более желательна для декоративных целей.
Причины ювенильности не выяснены, но определенную роль здесь, конечно, играет гормональный баланс. У плюща (Hedera helix) опрыскивание гиббереллином взрослой формы вызывает частичное обратное превращение в ювенильную форму (рис. 14.12). Видимо, гиббереллины имеют какое-то отношение к ювенильности хвойных деревьев; для более полного выяснения этого вопроса сейчас ведутся интенсивные исследования.
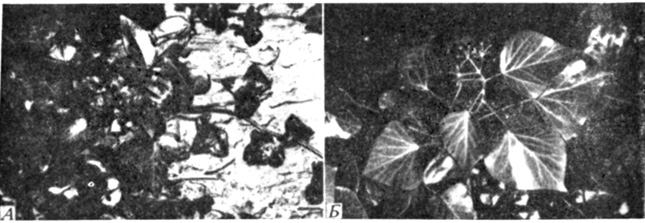
Рис. 14.12. Многие растения имеют различные ювенильные и взрослые формы. Хорошо всем известный плющ (Hedera helix) с его характерными листьями на самом деле представляет собой ювенильную форму (А). Взрослое растение - это высокий кустарник с простыми листьями (Б)
Размножение растений
Растения могут размножаться половым способом с помощью семян или же бесполым путем (вегетативно), используя определенную часть своего тела для воспроизведения целого растения. Почти все растения могут размножаться вегетативно, и этим они отличаются от животных, из которых лишь наиболее просто организованные могут увеличивать свою численность, не проходя через стадию половых клеток. Каждый способ размножения имеет свои преимущества и недостатки. Образование семян позволяет давать большое число потенциальных новых индивидуумов, которые затем разносятся ветром, водой и животными по обширной территории. Кроме того, поскольку при образовании семян происходит обычно генетическая рекомбинация, возникают новые варианты, которые могут оказаться лучше приспособленными к новой и изменяющейся среде. С другой стороны, вегетативное размножение, давая меньшее число особей, обеспечивает "родительскую" поддержку и питание для раннего роста; проростки же в отличие от этого располагают лишь минимальным запасом питательных веществ в эндосперме или семядолях и должны быстро перейти на собственный фотосинтез. Вегетативное размножение обычно не способствует широкому распространению вида, и поскольку все особи генетически однородны, у них меньше возможностей приспособления к изменяющимся условиям среды. Этот способ имеет важное хозяйственное значение, так как позволяет размножать желательные сорта.
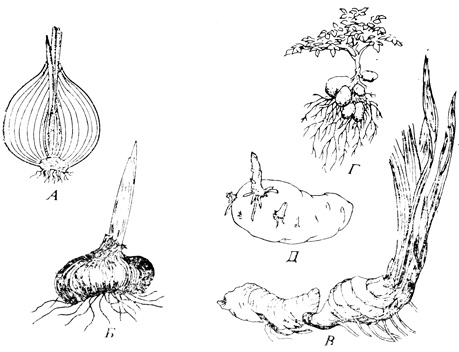
Рис 14.13. Запасающие органы используются для вегетативного размножения растений, так как у всех растений образуется по нескольку таких запасающих органов и каждый из них дает начало новому растению. А. Разрез луковицы лука (набухшие основания листьев). Б. Прорастание клубнелуковицы гладиолуса (утолщенный горизонтальный подземный стебель). Г. Растение картофеля (Solarium tuberosum) с клубнями (утолщенный подземный стебель). Д. Прорастание клубня картофеля. (Muller W. H. 1974. Botany. A Functional Approach, 3rd Edition, Macmillan, New York.)
У многих растений имеются природные способы вегетативного размножения, используемые человеком с доисторических времен. Один из распространенных методов - размножение с помощью запасающих органов (луковиц, корневищ, клубней), способных давать новые растения (рис. 14.13). Стелющиеся стебли, столоны и усы могут в некоторых местах укореняться, и каждая точка укоренения способна дать независимое растение (рис. 14.14). Кроме того, садоводы разработали целый ряд искусственных способов вегетативного размножения. Эти способы, связанные с методами культуры клеток и тканей, по-видимому, будут играть в дальнейшем все возрастающую роль в коммерческом размножении растений. В этом разделе мы рассмотрим некоторые физиологические принципы, на которых основано размножение растений.
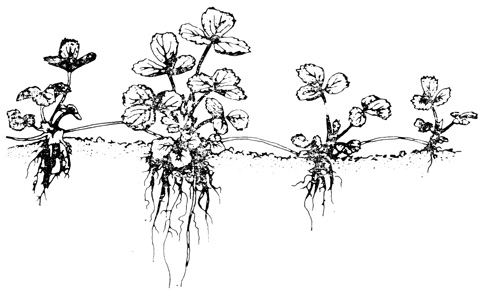
Рис. 14.14. Некоторые растения размножаются вегетативно с помощью стелющихся стеблей. Изображенное здесь растение земляники образует усы, которые укореняются через определенные расстояния, давая начало новым растениям. (Muller W. H. 1974. Botany. A Functional Approach, 3rd Edition, Macmillan, New York.)
Прорастание семян. Многие виды культурных растений при благоприятной температуре и влажности прорастают без специальной обработки. Это результат длительной селекции человеком, направленной против покоя семян или необычных потребностей для прорастания. Однако семенам некоторых декоративных растений для прерывания покоя необходим свет или холод, который снижает в них содержание ингибиторов или повышает уровень стимуляторов прорастания (см. гл. 110, 11 и 12). У других семян имеется непроницаемая семенная оболочка, препятствующая поступлению внутрь воды и кислорода. В природе такие прочные семенные оболочки разрушаются постепенно бактериями. Поскольку это дает невыровненные посевы, такие семена можно скарифицировать (шлифовать) механически или химически с целью разрушения оболочки. Если предварительная обработка позволит воде и кислороду проникнуть в семя, оно быстро прорастет. Намачивание семян в воде или их промывание тоже можно применять для размягчения оболочки и удаления ингибиторов. Семена, нуждающиеся в свете, следует высевать на поверхность почвы, а семена, требующие холодовой обработки, увлажняют и помещают перед посевом в холодильник или вне помещения при температуре 2-7°С на 1-4 месяца. При холодовой обработке важен доступ кислорода и влаги. Это обычно достигается стратификацией - помещением влажных семян между слоями смеси песка и торфа. Обработка гормонами для индукции прорастания используется не так широко, хотя для улучшения прорастания семян, нуждающихся в свете и холоде, можно применять гиббереллин.
Размножение черенками и прививкой. При размножении черенками срезают верхушку стебля и ее основание помещают в хорошо аэрируемую, влажную среду - почву или песок. Чтобы предотвратить завещание этих отрезков без корней, часто поддерживают их влажность путем помещения в полиэтиленовый мешочек или создания водного аэрозоля. Образование каллуса и ксилемы, пролиферация камбия и закладка корней происходят в ответ, на повышение концентрации ауксина в результате его базипетального перемещения из верхушки стебля. Укоренение можно улучшить небольшим прогревом почвы и обработкой поверхности среза синтетическими ауксинами, например индолил-масляной или α-нафтилуксусной кислотой (НУК) (рис. 14.15). На поверхности среза обычно развивается каллус и корни начинают расти около наружных краев сосудистых пучков или - у древесных растений - от молодой вторичной флоэмы. Некоторые черенки лучше укореняются без нанесения ауксинов, вероятно потому, что уже содержат их в достаточном количестве. Черенки, синтезирующие слишком мало собственного ауксина, нуждаются в его добавлении.

Рис. 14.15. Влияние ауксинов на заложение корней на черенках. Слева - необработанный черенок камелии, справа - черенок, обработанный раствором ИМК и НУК. (С любезного разрешения Boyce Thompson Institute for Plant Research.)
При прививке верхушку стебля или почку от одного растения (привой) вставляют в расщеп стебля другого растения (подвоя), и они срастаются, образуя единую особь (рис. 14.16). Этот способ применяют тогда, когда корни подвоя более мощны или более устойчивы к болезням, чем корни растения, побег которого хотят получить. Место соединения обвязывают и обрабатывают воском или другим защитным материалом, чтобы предотвратить обезвоживание. В случае приживления черенка в результате дифференциации тканей подвоя в сосудистые элементы образуется сосудистое соединение между привоем и подвоем. Дифференциацию сосудов отчасти вызывает ауксин, синтезируемый верхушкой привоя и диффундирующий из его основания. В садоводстве получили распространение различные типы прививок. Выбор того или иного типа зависит от вида растений.
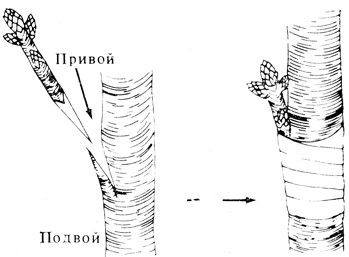
Рис. 14.16. При прививке привой с почками вставляют в расщеп стебля (подвоя). Это место крепко обвязывают и оставляют в таком виде до тех пор, пока ткани привоя и подвоя не срастутся. Ауксин, поступающий из почки, стимулирует образование сосудистого соединения между привоем и подвоем
Использование тканевых культур. Успешное получение культур растительных тканей в лаборатории естественно привело к их использованию в садоводстве для размножения растений. Кусочек стерилизованной растительной ткани помещают на агар, содержащий необходимые питательные вещества, а также ауксин и цитокинины, соотношение между которыми определяют экспериментальным путем. Ткань на такой среде быстра разрастается, образуя каллус. Растущую ткань можно многократно делить и таким образом получать ее в большом количестве из первоначального крошечного эксплантата. Изменяя гормональный баланс, можно вызывать образование корней и побегов (рис. 14.17). Получаемые растения отделяют от родительского каллуса и выращивают обособленно на агаре до тех пор, пока они не станут достаточно крупными для высаживания в сосуды с почвой.
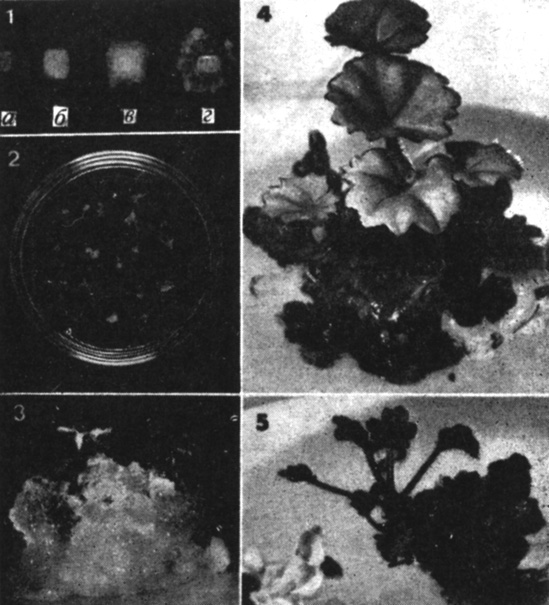
Рис. 14.17. Образование корней и побегов из недифференцированной сердцевины стебля у Pelargonium (герань). 1. Ткань сердцевины, выращенная на основной среде, содержащей ИУК (5 мкМ), бензиладенин и цитокинин (1 мкМ); а, б, в и г - 1-й, 15-й, 30-й и 60-й день соответственно. На 60-й день появились организованные клубеньки. 2. Крохотные растеньица с корнями и побегами, сформировавшиеся из изолированных клубеньковых телец (1, г). 3. Фрагменты почек, образовавшиеся на каллусе. Обратите внимание на железистые волоски на листьях. 4. Более крупные листья и почки. 5. Корень (показан стрелкой) сформировался из основания растущей почки. (Chen, Galston, 1967. Physiol. Plant., 20, 533-539.)
Более быстрый способ вегетативного размножения с помощью культуры тканей состоит в прямом отделении верхушек стебля и выращивании их на агаре. В этих условиях апекс образует каллус, и в конечном результате получается много небольших побегов, которые можно выращивать отдельно и высаживать в сосуды (рис. 14.18). Главное преимущество этого метода заключается в том, что он благоприятствует быстрому клоновому размножению растений, семенное потомство которых расщепляется, а вегетативное размножение обычными способами происходит очень медленно. Этот способ использовали также для получения безвирусных линий растений, так как многие системные вирусы, перемещающиеся по флоэме, не проникают в апикальную точку роста, которая не связана с флоэмой.

Рис. 14.18. Использование культуры тканей для размножения садовых растений в коммерческих целях. Апекс хризантемы отрезают и помещают в колбу со стерильным питательным раствором, содержащим 0,02 мг/л НУК и 2 мг/л кинетина, укрепляемую на вращающемся устройстве. Из апекса вырастает каллус (А), из которого затем могут сформироваться целые растения. Этот каллус распадается на многочисленные кусочки, которые продолжают расти. Примерно через 3 мес кусочки вынимают из раствора и помещают на твердук агаровую среду того же состава. В результате развивается множество крошечных растеньиц (Б, 4 мес). Эти растеньица можно разделить и поместить по отдельности на агар. Когда они подрастут (через 6 мес), их пересаживают в горшочки. Таким способом можно выращивать растения на продажу, причем все они будут идентичны первоначальному растению. (С любезного разрешения R. W. Langhans, Cornell University.)
Эти способы, сейчас весьма обычные, десятилетиями использовали для получения орхидей. Апекс побега орхидеи выращивают для получения массы ткани, которую можно затем разделить на множество кусочков. Эти кусочки вращают в питательных растворах, чтобы предотвратить развитие полярности и дифференциацию (рис. 14.19). Затем их пересаживают на питательный агар, где они формируют побеги, корни и развиваются в маленькие растеньица, которые позднее высаживают в сосуды. Сходные методы используют сейчас для гвоздик,, хризантем и некоторых других растений. Вероятно, вскоре во многих крупных теплицах и питомниках будут оборудовать специальные помещения для получения растений из тканевых культур.

Рис. 14.19. Часть специальной установки для размножения культуры тканей в большом масштабе для коммерческих целей. Слева видны содержащие ткань и культуральную среду колбы, вращающиеся на клиностате, чтобы предотвратить гравитационную стимуляцию полярности и дифференциации. Справа показана термостатированная камера с регулируемыми условиями инкубации, в которой выращивается множество культур. (С любезного разрешения R. W. Langhans, Cornell University.)
Культура тканей почти наверняка окажется полезной при размножении древесных видов, которые не скоро дают семена или же не передают семенному потомству желаемые признаки. Недавно удалось вывести ряд быстро растущих линий хвойных деревьев, но, поскольку они много лет не образуют семян, размножение их представляет большую проблему. Сейчас ведутся интенсивные исследования, направленные на то, чтобы добиться образования и роста тканей хвойных в культуре с последующей регенерацией всего растения. Последняя фаза часто оказывается камнем преткновения, а без нее культура тканей имеет лишь ограниченную практическую ценность. Некоторые изолированные органы, такие, как корни, могут синтезировать нужные нам вещества, например алкалоиды; культура таких органов может быть экономически выгодна.
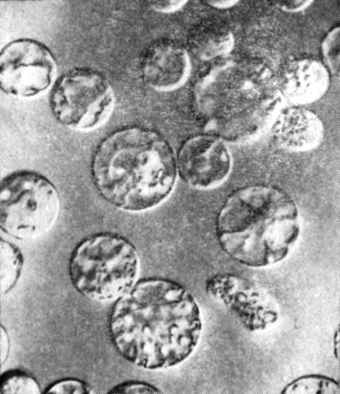
Рис. 14.20. Протопласты, полученные из суспензии культивируемых клеток табака (Nicotiana tabacum). Увеличение X500 достигнуто с помощью контрастной оптической системы Номарского методом дифференциальной интерференционной микроскопии. Обратите внимание на сферическую форму протопластов с четко выраженной мембраной, на цитоплазматические нити, вакуоли, хлоропласты и ядра. (С любезного разрешения L. C. Fowke, University of Saskatchewan.)
Использование культур клеток и тканей в селекции растений. Помимо того что культура тканей используется при вегетативном размножении растений, она может служить также средством для осуществления необычного пути их полового воспроизведения. Предположим, что мы имеем высокоурожайное культурное растение, восприимчивое к определенной болезни, и родственный, но не скрещивающийся с ним вид, устойчивый к данной болезни. Если их нормального скрещивания нельзя достичь с помощью опыления, то не существует никакого другого полового способа для введения в растение признака устойчивости к болезни. Однако сейчас стало возможным пара- сексуальное слияние культивируемых соматических клеток. Обычные растительные клетки не могут сливаться в культуре, так как их стенки препятствуют объединению протопластов. Однако с помощью смеси ферментов, разрушающих клеточные стенки, их можно растворить. Вначале для отделения одной клетки от другой используется пектиназа. Затем для разрушения стенок отдельных клеток применяют целлюлазу. Протопласты (содержимое живых клеток) можно затем собрать в виде осадка путем осторожного центрифугирования, обращаясь с ними как со свободноживущими микроорганизмами, лишенными оболочек (рис. 14.20). Если разрушение стенок производят в гипертоническом растворе, чтобы предотвратить разрыв протопластов, то изолированные ("голые") протопласты остаются живыми. В соответствующих условиях у них может вновь образоваться стенка, они начинают делиться и затем регенерируют в целое растение. Если протопласты от двух разных видов растений смешать в присутствии индуцирующих слияние агентов, таких, как полиэтиленгликоль, то небольшая часть этих протопластов сольется друг с другом, образовав гетерокарионы (рис. 14.21), т. е. клетки, содержащие множество ядер от разных источников (рис. 14.22). При слиянии ядер могут образоваться настоящие парасексуальные гибриды.
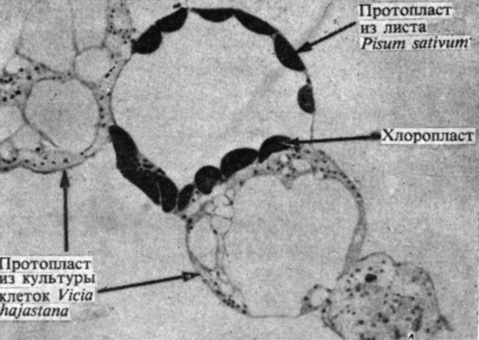
Рис. 14.21. Протопласт из листа гороха, слипшийся с несколькими протопластами, полученными из культуры тканей вики. Слипание протопластов достигнуто благодаря использованию высоких концентраций полиэтиленгликоля. Этот срез толщиной 1 мкм был окрашен толуидиновым синим. (С любезного разрешения L. C. Fowke, University of Saskatchewan.)
После получения продуктов слияния необходимо иметь в своем распоряжении какой-либо селекционный метод, позволяющий отделить гибриды от продуктов самослияния клеток каждого исходного типа. Если протопласт одного вида устойчив к веществу А, но чувствителен к веществу Б, то последнее можно использовать для того, чтобы убить этот протопласт или продукты его внутривидового слияния. Если у протопластов другого вида обнаруживается обратная картина устойчивости и чувствительности к данным веществам, то для их уничтожения можно применить вещество А. В том случае, когда устойчивость к обоим этим веществам передается всем образовавшимся гибридным протопластам, они одни оказываются устойчивыми как к тому, так и к другому соединению. Таким образом, только гибридные (слившиеся) протопласты будут способны расти на среде, содержащей оба соединения. И наоборот, если, например, протопласт А автотрофен в отношении ауксина, но не цитокинина, а протопласт Б автотрофен в отношении цитокинина, но не ауксина, то в среде, не содержащей обоих этих гормонов, смогут расти лишь продукты их слияния.
Парасексуальные гибридные растения, возникшие из соматических клеток, вероятно, должны быть тетраплоидными. Диплоидные гибриды образуются в том случае, если исходные клетки гаплоидны. Такие гаплоидные клетки можно получить, выращивая в культуре микроспоры или незрелые пыльцевые зерна пыльников.
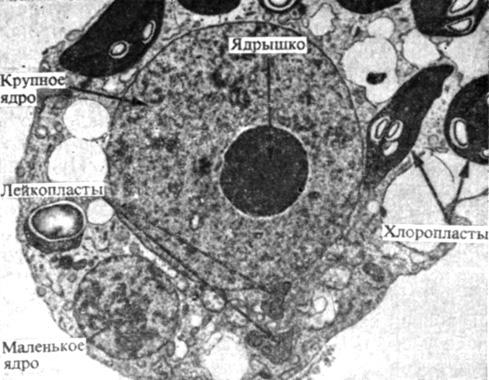
Рис. 14.22. Электронная микрофотография тонкого среза гетерокариона, образовавшегося путем индуцированного полиэтиленгликолем слияния протопластов из культуры клеток Vicia hajastana и клеток листьев Vida norbonensis. крупное ядро (с темным центральным ядрышком) и лейкопласты принадлежат V. hajastana, тогда как маленькое ядро и хлоропласты относятся к V. norbonensis. В таком гетерокарионе могут функционировать ядра и цитоплазматические органеллы обоих родительских протопластов. (С любезного разрешения L. C. Fowke, University of Saskatchewan.)
Данная область исследований переживает сейчас бурное развитие благодаря постоянному внедрению все новых методов. До сих пор полный цикл от выделения протопластов до регенерации целого растения был осуществлен лишь на немногих растениях (табак, петуния, морковь, спаржа, рапс), а парасексуальное слияние с получением гибридов достигнуто только у табака и петунии, представителей семейства Solanaceae. Пока не удалось добиться успешной регенерации у представителей семейств Gramineae и Leguminosae - двух самых важных семейств пищевых растений. Однако вполне вероятно, что гибридизация соматических клеток и регенерация целых растений будут осуществлены также и у представителей этих семейств, что в будущем сыграет важную роль в технологии улучшения культур (см. гл. 16).
Хранение убранного урожая
Так как плоды и овощи можно выращивать только в теплое время года, для снабжения ими населения в течение всего года необходимы какие-то способы их хранения. В прошлом в домах имелись прохладные подвалы, где на протяжении всей зимы хранились картофель, морковь и другие овощи. При хранении овощей в таких условиях происходили большие потери из-за их усыхания, а позже - и прорастания. Такие плоды, как яблоки, можно было хранить около двух месяцев, но к концу этого периода они уже были почти несъедобны. При современных методах хранения все это изменилось. Теперь в июне можно купить яблоки, убранные в сентябре предыдущего года, и они почти не отличаются от тех, которые были в продаже прошлой осенью. Овощи, которые раньше нельзя было долго хранить, сейчас можно покупать круглый год в замороженном виде.
Для успешного хранения замороженных овощей, таких, как зеленый горошек, важно как можно быстрее их заморозить сразу же после уборки. Горох погружают на короткое время в горячую воду, чтобы быстро инактивировать гидролитические ферменты, и немедленно замораживают. Если затем температуру поддерживать примерно на уровне температуры замораживания, то такой продукт в закрытых пакетах будет храниться неограниченно долго.
Однако в большинстве случаев при замораживании плодов их ткани разрушаются, и поэтому такой способ хранения часто неприемлем. Вместо этого яблоки, например, можно хранить при охлаждении примерно до 4°С в контролируемой атмосфере, поддерживающей дыхание на минимальном уровне и предотвращающей высыхание плодов. При этом в окружающей среде обычно содержится мало O2 (5%), что снижает интенсивность дыхания; однако концентрация O2 не должна быть настолько низкой, чтобы вызвать анаэробное дыхание, так как это привело бы к большим потерям сухой массы. В атмосфере соответственно повышается уровень азота и вводится дополнительное количество CO2, которая противодействует влиянию этилена в случае его образования плодами. Подобным способом яблоки можно хранить месяцами. Однако при хранении в них происходят определенные изменения, и, хотя такие яблоки выглядят свежими и хороши на вкус, в обычных условиях их можно хранить только в течение нескольких дней, так как они быстро становятся мягкими и начинают гнить.
Лук, картофель и корнеплоды тоже хранят при пониженной температуре. Для картофеля эта температура не должна быть слишком низкой, так как при температурах, несколько превышающих температуры замораживания, крахмал ферментативно превращается в сахар и в результате картофель приобретает непривычно сладкий вкус. Если это происходит, то срок хранения картофеля снижается. Для подавления прорастания и связанного с ним размягчения и усыхания луковиц, клубней или корнеплодов практикуется обработка растений ингибитором роста, таким, как гидразид малеиновой кислоты, за несколько недель до уборки.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'