
Определение содержания гормонов в растении
Для количественного определения ауксина в любой ткани растения эту ткань экстрагируют каким-либо растворителем, а затем наносят экстракт на другую ткань, которая количественно реагирует на содержащийся в нем ауксин. Обычно эту ткань помещают в диэтиловый эфир при температуре около 0°С и осторожно встряхивают в течение 2-4 ч. Полученную эфирную вытяжку затем концентрируют до небольшого объема и вводят в агаровый блок, который помещают на одну сторону чувствительного к ауксину декапитированного органа. Обычно для этой цели используют влагалище первого листа, или колеоптиль, выращенного в темноте овса. Асимметрично расположенный ауксин усиливает в исследуемом растении рост только той ткани, которая находится непосредственно под ним. Неравномерный рост двух сторон колеоптиля приводит к образованию изгиба, угол которого прямо пропорционален количеству введенного в блок ауксина (рис. 9.5). Таким образом, для количественного определения ауксина в неизвестном органе из него готовится вытяжка, которая наносится на чувствительный к ауксину орган. Возникший изгиб измеряется и сравнивается с изгибами, вызванными известными количествами ауксина в других сериях опытов. Описанный метод использования ответной реакции организма для измерения количества химического соединения, содержащегося в вытяжке, называется биотестом.
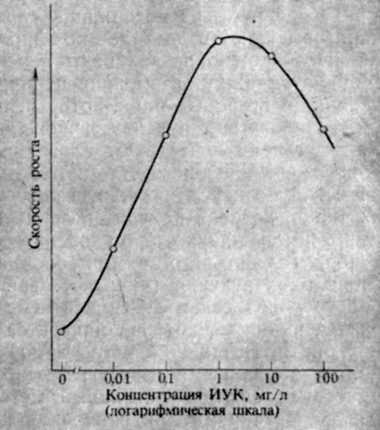
Рис. 9.4. Зависимость влияния ИУК на рост отрезков стебля гороха от ее концентрации (Galston, Hand., 1949. Amer. J. Bot., 36, 85-94)
Биотесты, основанные на индукции определенного уровня ответной реакции, развивающейся обычно у растений под воздействием данного гормона, существуют для всех растительных гормонов. В настоящее время их постепенно вытесняют химические и физические методы главным образом потому, что, хотя биотесты и просты в исполнении, они подвержены воздействию целого ряда внешних факторов. Общим недостатком биотестов является, например, то, что из ткани вместе с гормонами часто экстрагируются ингибирующие соединения. Такая смесь вызывает более слабую ростовую реакцию, чем та, которая могла бы возникнуть под воздействием данного количества ростового гормона в отсутствие ингибиторов. В результате сведения о содержании в ткани определяемого гормона оказываются ошибочными. Большинство современных методов основано на очистке гормонов, содержащихся в полученном экстракте, хроматографическими методами, такими, как хроматография на бумаге; в тонких слоях силикагеля или на колонках с шариками из синтетической смолы. Самым чувствительным методом является газовая хроматография. При ее использовании летучее производное гормона отделяется от примесей в процессе его прохождения с током газа при повышенной температуре через колонку с материалом, который по-разному поглощает гормон и примеси. Другой современный метод - жидкостная хроматография при высоком давлении. В этом методе раствор гормона с примесями под давлением проходит через колонку, заполненную материалом с разной поглотительной способностью по отношению к гормону и примесям. Поскольку во всех этих методах для прохождения гормона и примесей через колонку требуется разное время, гормон очищается и его можно определить непосредственно. Как в газовой, так и в жидкостной хроматографии под высоким давлением гормон можно обнаружить и идентифицировать после очистки. Физический детектор того или иного типа выполняет эту операцию сразу же после выхода определяемых соединений из колонки. ИУК, например, можно обнаружить и количественно определить, измеряя при определенной длине волны флуоресценцию, возбуждаемую при облучении раствора ультрафиолетовыми лучами с определенной длиной волны. Гиббереллины идентифицируют с помощью масс-спектрометра, в который эти соединения поступают непосредственно из колонки газового хроматографа. Масс-спектрометр - сложно устроенный прибор - используется для того, чтобы расщепить все молекулы исследуемого вещества на множество молекулярных ионов {ионизацию проводят путем бомбардировки вещества пучком электронов или другими способами), которые затем разделяются в соответствии с величиной отношения их массы к заряду. Поскольку регистрируемые наборы фрагментов (молекулярных ионов) характерны для определенных исходных молекул, с помощью этого прибора можно идентифицировать и количественно определить любой гормон.
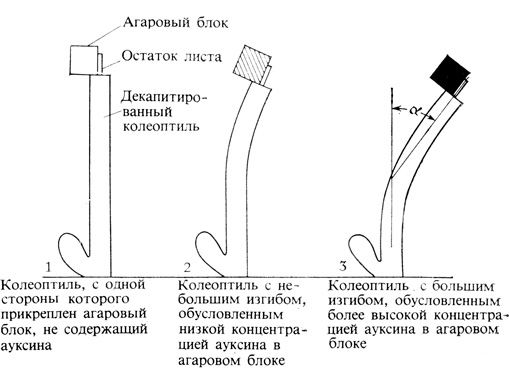
9.5. Определение концентрации ауксина с помощью теста на изгиб колеоптиля овса. Угол α пропорционален содержанию ауксина в агаровом блоке
Тропизмы и транспорт ауксина
Изгибы, вызываемые односторонним нанесением ауксина на растение, напоминают изгибы разных органов растения, возникающие под влиянием света или силы тяжести. Действительно, мы теперь знаем, что такие изгибы (тропизмы) связаны с асимметричным распределением ауксина в рассматриваемом органе. Например, если колеоптиль овса освещать светом низкой интенсивности с одной стороны или светом различной интенсивности с разных сторон, то этот орган обычно изгибается в сторону более яркого света (фототропизм). Изгибание происходит потому, что на стороне, обращенной к источнику света, рост несколько подавляется светом, а на противоположной - ускоряется (рис. 9.6). Если удалить верхушку односторонне освещенного колеоптиля и с помощью описанного выше теста на изгиб определить содержание ауксина в обеих его половинах, то в затененной половине ауксина окажется примерно в два раза больше, чем в освещенной. Однако если затенять или освещать целиком всю верхушку колеоптиля, то ауксина в затененной верхушке будет не больше, чем в освещенной. Из этого физиологи заключили, что свет вызывает изгибание органа, воздействуя на латеральное распределение в нем ауксина. Разница в концентрации ауксина в свою очередь обусловливает неодинаковую скорость роста органа с двух его сторон, что и приводит к возникновению изгиба.
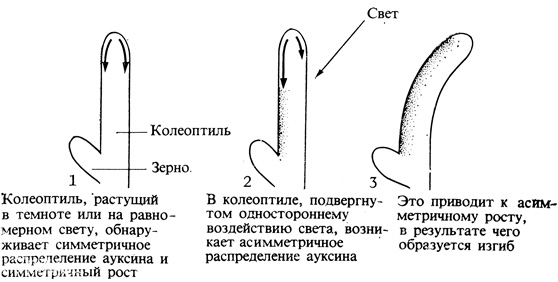
Рис. 9.6. Объяснение фототропизма, основанное на распределении ауксина
Аналогичным образом нижняя поверхность стебля, находящегося в горизонтальном положении (рис. 9.7), через некоторое время будет содержать больше ауксина, чем верхняя. Это приведет к ускоренному росту нижней стороны и в конечном счете к изгибанию стебля вверх (геотропизм) (рис. 9.8). Рост горизонтально расположенного корня вниз обусловлен (по крайней мера частично) различной чувствительностью корня к ауксину. В таком корне, как и в находящемся в горизонтальном положении стебле, ауксин накапливается на нижней стороне. Однако, поскольку в нормальном корне уже имеется оптимальная или даже сверхоптимальная концентрация ауксина, ее дальнейшее повышение на нижней стороне подавляет рост и тем самым вызывает изгибание корня вниз. Позднее проведенные исследования показали, что другие гормоны играют более важную роль в возникновении тропизмов корня. Например, было высказано предположение, что абсцизовая кислота - гормон ингибирующего действия - может также накапливаться на нижней стороне горизонтального корня и таким образом способствовать подавлению там роста клеток. Мы обсудим это явление ниже.
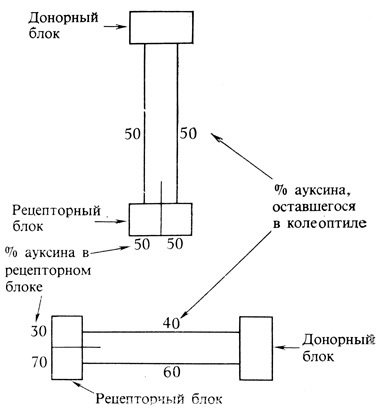
Рис. 9.7. Колеоптиль кукурузы в нормальном вертикальном (вверху) и горизонтальном (внизу) положениях. Эта геотропическая стимуляция вызывает перераспределение симметрично нанесенной ИУК. Вследствие более высоких концентраций ИУК на нижней стороне колеоптиля эта сторона растет быстрее, в результате чего колеоптиль изгибается вверх. (Gillespie, Thimann. 1963. PI. Phys., 38, 214-225.)
Физиологи растений не знают точно, каков механизм, с помощью которого растения детектируют односторонний свет и гравитационные стимулы. Спектр действия фототропизма показывает, что только синий свет и определенная часть ультрафиолета вызывают образование изгибов. В качестве фоторецептора в этом процессе может участвовать желтый пигмент, вероятно родственный каротину или рибофлавину (рис. 9.9). Многие другие реакции в растениях и грибах обнаруживают аналогичную зависимость от длины волны. В некоторых грибах синий свет, поглощаемый каким-то ферментом, содержащим флавин, вызывает восстановление цитохрома, что можно выявить с помощью спектрофотометра. В настоящее время считается, что эта реакция занимает, вероятно, центральное место в механизме, ответственном за фототропическое восприятие у растений, и связана каким-то еще не совсем понятным образом с последующей физиологической ответной реакцией.
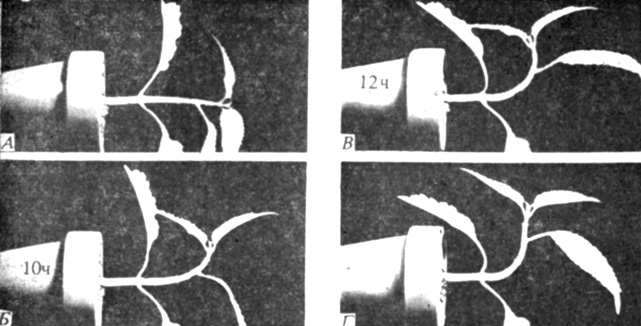
Рис. 9.8. Геотропическая реакция побега колеуса, помещенного в горизонтальное положение. Снимки выполнены сразу после помещения побега в горизонтальное положение (А) и через 10 (Б), 12 (Б) и 18 ч (Г) после этого. Обратите внимание на положение верхней части побега на снимке В, исправленное затем растением. (С любезного разрешения C. R. Granger, Washington University.)
В механизме, лежащем в основе реакции растения на силу тяжести (восприятие силы тяжести), по-видимому, участвуют статолиты, особо плотные зерна крахмала, перемещающиеся от одной стенки к другой при наклоне клетки (рис. 9.10). Под действием силы тяжести или центробежной силы они располагаются асимметрично у клеточных стенок, сигнализируя каким-то образом об изменении ориентации стебля или корня. Кроме того, некоторые другие органеллы в клетках, такие, как эндоплазматический ретикулум, поднимаются к верхней стороне клеток при наклоне верхушки растения в ту или иную сторону. Таким образом, в восприятие силы тяжести могут быть вовлечены и другие сигналы помимо тех, которые связаны с перемещением крахмальных статолитов. Какова бы ни была воспринимающая органелла, раздражение превращается в химический сигнал, очевидно, благодаря близости органеллы к периферической плазмалемме.
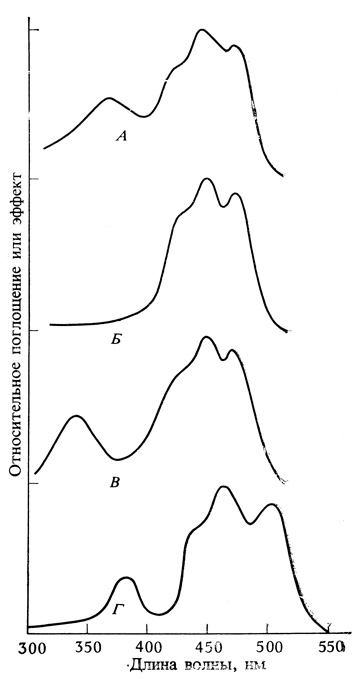
Рис. 9.9. Сравнение спектра действия фототропизма (А) со спектрами поглощения транс-β-каротина (Б), неизвестного в природе цис-β-каротина (В) и рибофлавина (Г), растворенных в касторовом масле (Galston. 1967. Amer. Sci., 55. 144-160)
Восприятие как направленного света, так и силы тяжести происходит в кончике корня и верхушке стебля. В корне чувствительной зоной является чехлик (рис. 9.11), богатый крахмальными зернами, тогда как в стебле раздражение воспринимается верхушкой, включающей самые молодые листья. Однако зона, в которой развивается ответная реакция на вызывающий тропизм раздражитель, находится на некотором расстоянии (порядка нескольких миллиметров или сантиметров) от чувствительных клеток, расположенных в кончике корня или верхушке стебля. Так, ауксин должен мигрировать от верхушки стебля до лежащей под ним зоны роста. Этот процесс при нормальной температуре происходит примерно со скоростью 1 см/ч путем перемещения ауксина по клеткам паренхимы колеоптиля или по сердцевинной паренхиме и самым молодым недифференцированным сосудистым клеткам стебля. Однако такой транспорт необычен в том отношении, что он осуществляется лишь в одном нетто-направлении, а именно от верхушки стебля (рис. 9.12). Поэтому если приложить блок содержащего ауксин агара к морфологическому апексу стебля, то это приведет к быстрому переходу ауксина в ткань стебля, откуда его можно собрать путем экстрагирования или диффузии в базальный блок. Однако если такой же блок приложить к основанию того же кусочка ткани, то ауксин не будет перемещаться от основания к апексу и далее в рецепторный блок. Односторонний транспорт ауксина в стеблях и колеоптилях называется полярным транспортом. Физиологическая основа полярного транспорта ауксина до конца еще не выяснена, но его механизм, вероятно, включает некоторые из перечисленных ниже этапов (рис. 9.13). Ауксин в виде неионизированной молекулы ИУК диффундирует из нижнего конца одной клетки в верхнюю часть лежащей под ней другой клетки. Поскольку цитоплазма имеет почти нейтральную реакцию, а клеточная стенка - слабокислую, ИУК снаружи клетки менее ионизирована, чем внутри нее. Следовательно, существует градиент диффузии, благодаря которому неионизированная ИУК может проникать в клетку. Присутствующая в клетке ионизированная ИУК нерастворима в липидах и потому не может диффундировать наружу, тогда как неионизированная ИУК продолжает поступать в клетку. В результате ИУК накапливается внутри клетки. Высказано предположение, что ИУК может выходить из клетки с помощью специфических белков-переносчиков, расположенных в клеточной мембране на нижнем конце клетки. Они способны захватывать находящуюся в клетке ионизированную ИУК и транспорта-
Рис. 9.12. Односторонний ток ауксина по ткани колеоптиля.
ровать ее наружу. Поскольку концентрация ионизированной ИУК внутри клетки выше, чем снаружи, белки-переносчики действуют по существу как турникеты, через которые ионизированная ИУК выходит из клетки, а затем увлекается в соседнюю клетку. Эти гипотетические переносчики ауксина расположены только в нижней части клетки, и поэтому ауксин может перемещаться лишь в одном направлении - от апекса к основанию. Таким образом, предполагается, что полярность обусловлена структурными особенностями клетки на молекулярном уровне.
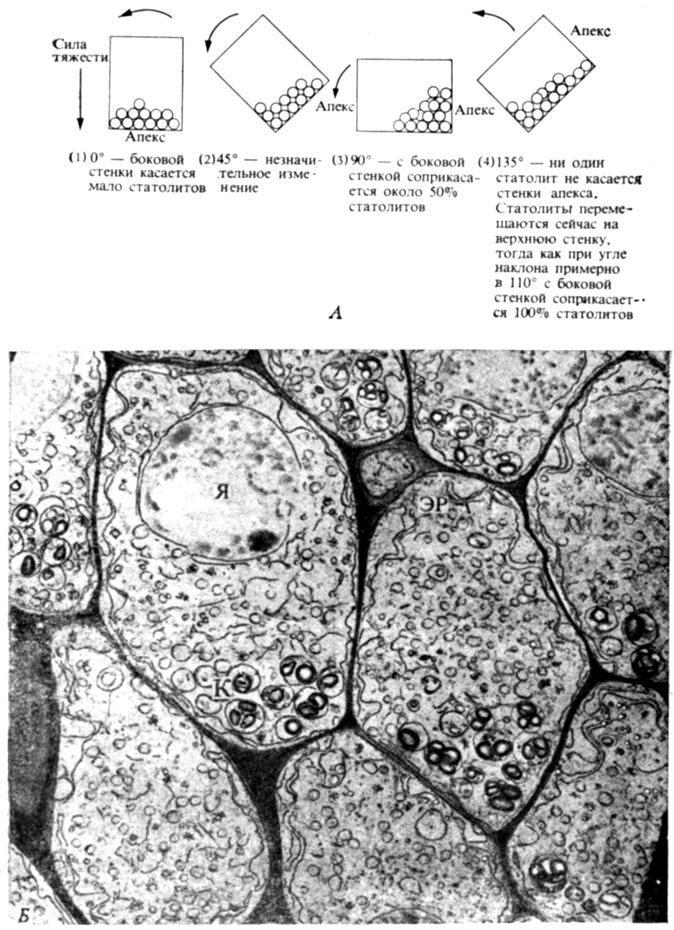
Рис. 9.10. А. Если представить клетку корневого чехлика в виде ящика, заполненного шариками, символизирующими зерна крахмала, то можно понять, каким образом они перемещаются при изменении положения корня от вертикального к горизонтальному. Максимальное число шариков будет касаться боковой стенки при ее отклонении от вертикали на 110°, т. е. точно при той величине угла, при которой отмечается наибольшая геотропическая реакция. Б. В настоящей клетке корневого чехлика, как видно на электронной микрофотографии, мы можем наблюдать эффект, подобный тому, который наблюдается в ящике (А). Зерна крахмала (К) переместились на нижнюю сторону клетки, а эндоплазматический ретикулум (ЭР) и ядра (Я) - к вершинам клеток. Такие изменения, возможно, улавливаются клеточной мембраной и преобразуются в гормональные сигналы, регулирующие направление роста корня. (С любезного разрешения E. B. Juniper, Oxford University.)
Полярный транспорт требует также активной метаболической энергии, которая необходима хотя бы для того, чтобы поддерживать в цитоплазме более высокий pH, чем снаружи. Это может осуществляться благодаря активному выкачиванию ионов H+ из клетки с использованием АТР в качестве источника энергии.
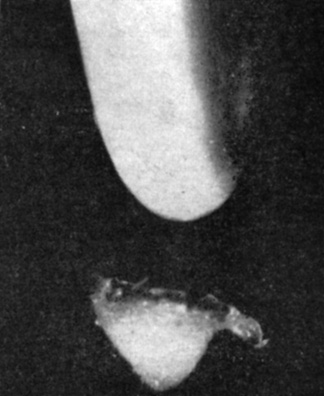
Рис. 9.11. Корневой чехлик представляет собой группу защитных, непрерывно слущиваемых клеток, плотно лежащих вокруг кончика корня. На рисунке виден корневой чехлик, снятый с кончика корня. Корневой чехлик способствует проникновению корня в почву. Другой его функцией является восприятие силы тяжести. В нем находятся крахмальные статолиты и образуется ингибитор роста корня, участвующий в геотропизме (см. гл. 10). (С любезного разрешения д-ра B. E. Juniper, Oxford University.)
Мы должны сейчас подытожить проведенное здесь обсуждение тропизмов, хотя в нашем понимании этих явлений есть еще много пробелов. Мы не знаем, каким образом рецепторы односторонне направленного света или гравитационного раздражения влияют на латеральное распределение ауксина; правда, неравномерное распределение ауксина на двух сторонах стимулированного стебля или корня возникает, по-видимому, главным образом вследствие его поперечной миграции. Например, симметрично нанесенная меченная 14С ИУК накапливается в затененной продольной половине фототропически стимулированного органа и нижней половине геотропически стимулированного органа. Одно из возможных объяснений такого эффекта состоит в том, что базипетальный транспорт (транспорт к морфологическому основанию) ингибируется на стимулированной стороне. В результате происходит непрерывная диффузия вещества из освещенной половины в затененную при фототропизме стебля и из верхней половины в нижнюю при его геотропизме.
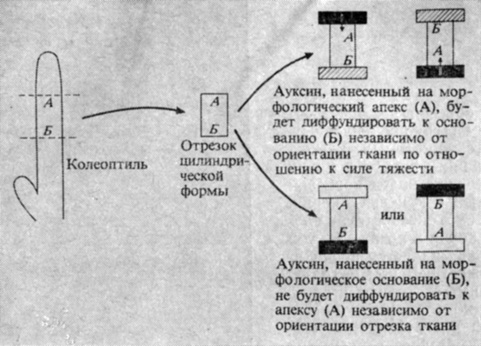
Рис. 9.12. Односторонний ток ауксина по ткани колеоптиля
Несколько другая ситуация наблюдается в корне. Корневой чехлик обладает чувствительностью ж силе тяжести. Сняв его с кончика корня, можно показать, что он служит также источником мощного ингибитора роста, который при асимметричном распределении вызывает образование изгибов. Опыты на отрезках корней, взятых за зоной роста, свидетельствуют, что перемещение ИУК в таких отрезках происходит в направлении к кончику корня, а не от него. Другими словами, здесь имеет место полярный транспорт, осуществляемый только в одном направлении - от верхушки стебля к кончику корня. Большая часть ИУК, обнаруживаемая в корнях, в действительности образуется в верхушке стебля, а затем транспортируется вниз по стеблю в кончик корня. Она накапливается также в тех местах, где развиваются новые боковые корни, и способствует там делению клеток. Корни все же вырабатывают очень небольшое количество ауксина, по всей вероятности, в корневом чехлике. Этот ауксин может мигрировать на расстояние 2-3 мм (или немного больше) назад в зону роста корня. Если корень изогнут, то ауксин из кончика переходит на нижнюю сторону этой зоны, где, возможно, ингибирует рост и тем самым приводит к изгибанию корня вниз. Другим компонентом ингибитора корневого чехлика, вероятно, является абсцизовая кислота (см. гл. 10). Недавно проведенные исследования показывают, что в корневых тропизмах она играет более важную роль, чем ауксин.
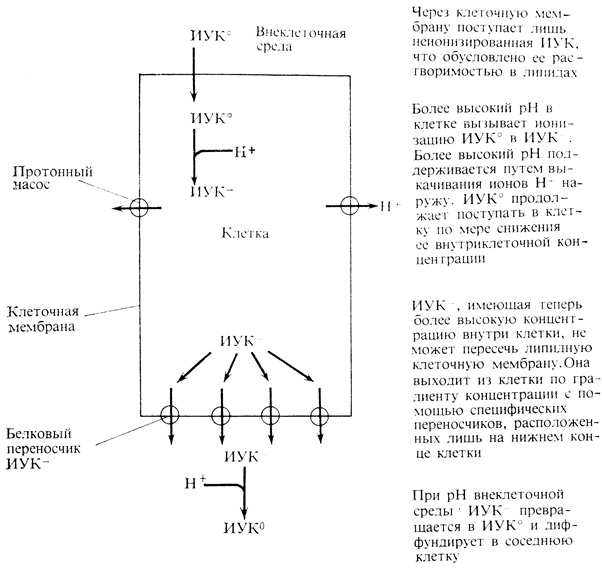
Рис. 9.13. Возможный путь, которым осуществляется полярный транспорт ауксина
У синтетических ауксинов, используемых для регулирования роста и развития растений, способность к перемещению связана с их активностью. Как правило, синтетические соединения, эффективно стимулирующие рост, обладают также и способностью к полярному транспорту. Это означает, что некоторая часть молекулы ауксина, ответственная за его действие, отвечает и за его связывание со специфическими участками транспортного белка. Когда мы измеряем контролируемый ауксином рост стебля, мы всегда находим, что скорость роста коррелирует не с общим содержанием ауксина, а с тем его количеством, которое способно к диффузии и выделяется из стебля, если его обрезать и поместить срезом на блок агара. Это свидетельствует о том, что не весь ауксин в клетке оказывает стимулирующее влияние на рост. Вероятно, рост контролируется ауксином, содержащимся в определенной части клетки, например в цитоплазме. Именно этот ауксин и доступен для транспортировки. Однако значительное количество ауксина может быть сосредоточено в других частях клетки, таких, как вакуоль, что делает его недоступным для транспортировки и неспособным оказывать влияние нарост; тем не менее если мы экстрагируем ткань растворителями и измерим в экстракте количество ауксина, то при этом будет учтен и неподвижный ауксин, что приведет к неправильной оценке действительной локализации различных форм ауксина в изучаемых клетках. Этот феномен компартментации имеет большое значение для всей физиологии: часто локализация того или иного соединения или фермента важнее, чем его общее содержание. Такое правило почти наверняка применимо не только к ауксину, но и ко всем другим гормонам.
Количество активного ауксина в любой части растения зависит от нескольких факторов: от уровня синтеза ауксина в верхушке стебля, доли транспортируемого гормона, его компартментации в клетках и, наконец, от количества ауксина, подвергшегося распаду или метаболизировавшегося другими путями. Известно, что ауксин под действием фермента ИУК-оксидазы превращается в неактивный продукт - 3-метиленоксиндол (см. рис. 9.3). Некоторые ткани в растении, особенно в корне, чрезвычайно активно разрушают ауксин этим путем. Имеют место также разные реакции конъюгации ауксина с другими молекулами, такими, как аспарагиновая кислота и инозит. Количество- этих продуктов обычно возрастает лишь тогда, когда на ткань- наносят чрезвычайно высокие дозы ИУК. Поэтому предполагается, что образующиеся соединения являются запасными веществами или продуктами детоксикации.
В семенах зерновых, где практически отсутствует свободная ИУК, при обработке ткани разбавленной щелочью появляется значительное количество этого соединения. В ткани ИУК содержится в форме гликозидов, т. е. в сочетании с производными сахаров. При прорастании эти вещества транспортируются к верхушке колеоптиля, где ИУК высвобождается и делается доступной, как уже говорилось выше, для базипетального полярного транспорта.
Другие функции ауксина
Кроме осуществления контроля за растяжением клеток ауксин может также инициировать деление клеток или способствовать этому. Если нормальные клетки, например стебля или корня, выращивать методом культуры тканей в определенной химической среде, то деление клеток будет зависеть от ауксина, вырабатываемого клетками или присутствующего в среде. Аналогичным образом начало камбиальной активности у деревьев весной частично контролируется ауксином, диффундирующим вниз от развивающихся почек. В корнях и стеблях закладка придаточных или боковых корней в зоне перицикла находится отчасти под контролем ауксина. Эта индуцирующая митоз деятельность осуществляется ауксином совместно с другой группой растительных гормонов - цитокининами, которые будут рассмотрены позже. Ауксин не только контролирует инициацию камбиальной активности, но, возможно, определяет также природу клеток, дифференцирующихся из камбиальных продуктов. Наличие ауксина в камбии на стороне, обращенной к ксилеме (главным образом в молодых дифференцирующихся элементах ксилемы, по которым он транспортируется от верхушки стебля), способствует развитию камбиальных производных на этой стороне камбия в ксилемные клетки (рис. 9.14). На внешней стороне камбия высокие концентрации сахаров и гиббереллинов в зрелой флоэме обусловливают развитие присутствующих здесь камбиальных производных во флоэмные клетки. Как мы увидим позже, гиббереллины продуцируются в основном молодыми раскрывшимися листьями и потому обычно находятся во флоэме совместно с образовавшимися при фотосинтезе сахарами.
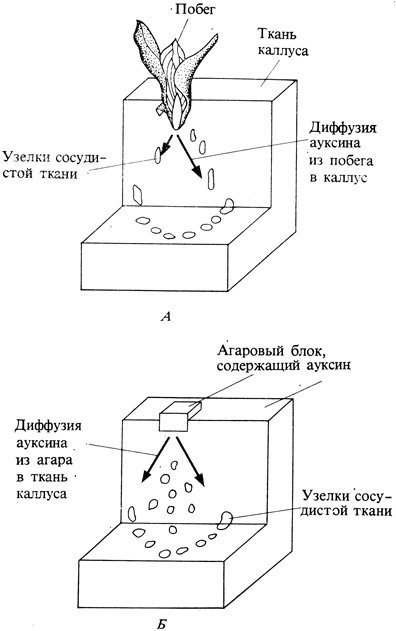
Рис. 9.14. При имплантации верхушки побега в верхнюю часть недифференцированного блока культуры каллусной ткани (Л) развиваются узелки сосудистой ткани, содержащей ксилему. Можно показать, что между этим эффектом и ауксином, вырабатываемым побегом, существует связь, если вместо побега использовать агаровый блок, содержащий ауксин. В этом случае также наблюдается развитие сосудистой ткани. В апексе стебля ксилема развивается под каждым листовым бугорком, который служит главным местом образования ауксина
В побеге, отделенном от растения, полярный транспорт ауксина, синтезированного верхушкой, приводит к его накоплению в основании стебля. Аналогично этому ауксин, нанесенный на побег, также накапливается в основании. Через некоторое время здесь под действием ауксина происходит формирование наплыва, или каллуса, содержащего множество паренхиматозных клеток, образовавшихся при делении камбиальных клеток в основании стебля. Такая каллусная ткань обычно недифференцирована, но может содержать беспорядочно ориентированные сосудистые элементы. Часто вслед за активацией камбиальных клеток ауксином в изобилии развиваются придаточные корни. Этот эффект широко используется в плодоводстве для размножения желаемых растений путем укоренения черенков (см. гл. 14).
Удивительное превращение завязи в плод - еще один контролируемый ауксином процесс. Обычно вслед за опылением и оплодотворением стенка завязи, из которой в конечном счете образуется плод, начинает чрезвычайно сильно разрастаться благодаря увеличению как числа клеток, так и их размеров. Об определенной роли ауксина в этом процессе свидетельствует резкое повышение его содержания в завязях и плодах во время их развития и то, что применение экзогенного ауксина в подходящий момент может ускорить весь этот процесс, а у некоторых видов даже заменить обычное опыление. Если пыльца не достигла пестика, то развитие завязи можно стимулировать нанесением на нее достаточно больших количеств синтетических ауксинов, что приводит к образованию "искусственных", или партенокарпических, плодов (рис. 9.15). β-Нафтоксиуксусной кислотой, например, можно опрыснуть или намазать завязь томата. В результате образуется довольно типичный плод - красного цвета, крупный и вкусный, но без жизнеспособных семян. Поскольку сама пыльца содержит мало ауксина, ее функция частично должна состоять в активации синтеза ауксина, возможно, путем внесения в завязь какого-то стимулятора фермента, ответственного за образование ауксина из его предшественников.

Рис. 9.15. Развитие цветоложа ('плода') земляники зависит от ауксина, вырабатываемого семенами, находящимися внутри семянок. А. Нормальный плод. Б. Плод того же возраста, но с удаленными семянками. В. Плод, у которого удалены все семянки, за исключением одной. Цветоложе разрастается лишь под этой семянкой. Г. Плод с удаленными семянками, замененными ланолиновой пастой, содержащей 100 ч, на млн. β-нафтоксиуксусной кислоты. (Nitsch. 1950. Amer. J. Bot., 37, 211-215.)
До сих пор мы рассматривали стимулирующее влияние ауксина на деление, растяжение и дифференциацию клеток. Но ауксин может также оказывать и ингибирующее или ограничивающее действие на рост отдельных частей растения. Так, он влияет на конкуренцию между разными почками стебля. У растений с сильным апикальным доминированием растут лишь верхушечные почки, тогда как рост нижележащих почек подавлен. При удалении верхушечных почек начинает расти одна или несколько нижележащих почек, причем одна из них обычно становится доминирующей. Но если после удаления верхушечной почки на поверхность среза нанести некоторое количество ауксина, то боковые почки не развиваются. Отсюда можно сделать вывод, что ауксин, поступающий из апикальной почки, подавляет развитие боковых почек. Последний факт свидетельствует о том, что "решение" об ингибировании или стимулировании роста боковых почек принимается исходя из конкурентного действия по меньшей мере двух ростовых гормонов - ауксина, идущего от апекса, и цитокининов, поступающих, вероятно, из корневой системы. Поэтому даже в системе, подавленной образованным верхушечной почкой ауксином, локальное нанесение цитокининов на угнетенную почку может вызвать ее избирательный рост. Если боковой почке удалось преодолеть ингибирование, то ауксин при повторном нанесении уже более не действует на нее угнетающе и может даже усилить ее рост.
Как действует ауксин
Как мы видели, ауксин может оказывать множество разнообразных воздействий на растения, регулируя такие процессы, как деление, растяжение и направление развития клеток во время их дифференциации. Он вызывает целый ряд физических, химических и физиологических изменений в клетках, причем некоторые из них происходят чрезвычайно быстро. Например, скорость движения цитоплазмы в отрезках колеоптиля овса увеличивается через несколько минут после нанесения на них ауксина. Хотя эта быстрая реакция может быть ранним проявлением действия ауксина, трудно связать ее непосредственно с растяжением клеток, которое в какой-то момент должно повлечь за собой существенные изменения в клеточной стенке. Маловероятно, что одна-единственная "доминирующая реакция" с участием ауксина ответственна за все эти эффекты. Поэтому физиологи растений исследовали несколько разных процессов. У нас сейчас есть вполне приемлемое представление о том, каким образом ауксин регулирует растяжение клеток. Мы постепенно подходим к разгадке механизма, с помощью которого ауксин контролирует другие аспекты развития.
В отличие от клеток животных протопласты растительных клеток заключены в полужесткий "деревянный" ящик - клеточную стенку. Независимо от того, какие изменения происходят внутри ящика, клетка не может увеличиваться в своих размерах, если ее стенки не способны растягиваться. Аналогичную ситуацию можно наблюдать и у животных: например, у представителя членистоногих - омара, у которого все тело заключено в жесткий наружный скелет, состоящий преимущественно из хитина. Животное может расти лишь тогда, когда старый жесткий наружный скелет сбрасывается в процессе линьки, а лежащий под ним новый слой остается в течение какого-то времени мягким и растяжимым. Клетки растений не могут сбрасывать свои клеточные стенки подобно тому, как омары сбрасывают свои наружные скелеты. Для них единственный путь увеличиться в объеме - это модифицировать существующую клеточную стенку, с тем чтобы сделать ее более растяжимой. Было показано, что ауксин играет в этом процессе существенную роль.
Ростом растительных клеток управляют два фактора: растяжимость клеточных стенок и тургорное давление клеточного содержимого, действующее на клеточную стенку. Мы можем представить себе эту ситуацию по аналогии с неполностью надутым воздушным шаром, в котором увеличение объема пропорционально внутреннему давлению и обратно пропорционально сопротивлению, оказываемому стенкой шара. Шар будет увеличиваться в размерах, если мы повысим внутреннее давление накачиванием в него воздуха. Это аналогично увеличению тургорного давления внутри клетки. С другой стороны, если бы мы смогли сделать стенку шара более растяжимой, воздействуя на нее размягчающими резину химикатами, то шар также увеличился бы в размерах, но без повышения первоначального внутреннего давления. Через 1-2 ч после нанесения ауксина на стебель или колеоптиль их клетки увеличиваются в размерах намного больше, чем соответствующие клетки в контрольном варианте без ауксина. Такое увеличение происходит в основном в длину, а не в ширину. Это обусловлено спиральным расположением целлюлозных микрофибрилл в "леточной стенке, что способствует скорее удлинению, чем радиальному росту клетки, а также тем, что ауксин увеличивает растяжимость клеточной стенки. Мы можем это измерить, если сначала прокипятим отрезок стебля или колеоптиля, для того чтобы убить его и устранить тем самым тургорное давление в клетках, а затем, зажав оба конца отрезка, определим силу, необходимую для его растяжения. Эта сила связана с растяжимостью стенки обратной зависимостью. Растяжимость стенки можно разложить на два компонента: пластическую растяжимость (необратимую деформацию) и эластическую (обратимую деформацию). Если прежде чем убить сегменты стебля растения, обработать их ауксином, то окажется, что для их необратимого растяжения до определенного предела потребуется меньше усилий, чем в контрольном опыте без применения ауксина. Такое индуцированное ауксином увеличение пластической растяжимости клеточной стенки наблюдается лишь в живых клетках. Ауксин не оказывает никакого влияния на растяжимость при его нанесении непосредственно на клеточные стенки в отрезках мертвого стебля или колеоптиля.
Как можно объяснить разрыхляющее действие ауксина на клеточные стенки? Может ли оно быть обусловлено, например, увеличением в клетке количества фермента целлюлазы, разрушающей клеточную стенку? Действительно, активность этого фермента резко возрастает через несколько часов после нанесения ауксина, и, следовательно, фермент мог бы разрушить некоторые целлюлозные микрофибриллы, повысив тем самым растяжимость стенки. Хотя сама по себе такая идея вероятна, активность целлюлазы, по-видимому, увеличивается лишь после того, как ауксин уже начал оказывать влияние на рост. Ясно, что любая приемлемая теория действия ауксина должна включать процесс, который начинается до стимулированного ауксином увеличения скорости роста.
Чтобы точно определить, с какого момента начинает увеличиваться скорость роста после нанесения ауксина, ученые используют прибор, изображенный на рис. 9.16. С помощью этого прибора можно измерить с точностью до нескольких секунд время, в течение которого происходят любые изменения длины отрезка стебля. Через 10-15 мин после добавления ауксина еще не отмечается увеличения скорости роста. Затем рост быстро ускоряется и достигает наивысшей скорости в течение последующих 15 мин. Таким образом, промежуток времени от 10 до 15 мин после нанесения ауксина требуется для того, чтобы вызвать изменения в метаболизме, приводящие в итоге к ускорению роста. Эти изменения должны достичь своего максимума примерно через 30 мин. Поэтому любые изменения, которые не обнаруживаются в течение часа или несколько позже, не могут относиться к первоначальному действию ауксина на индуцирование роста. Однако они могли бы быть частью механизмов, которые должны 1включиться позже для поддержания индуцированного ауксином роста.
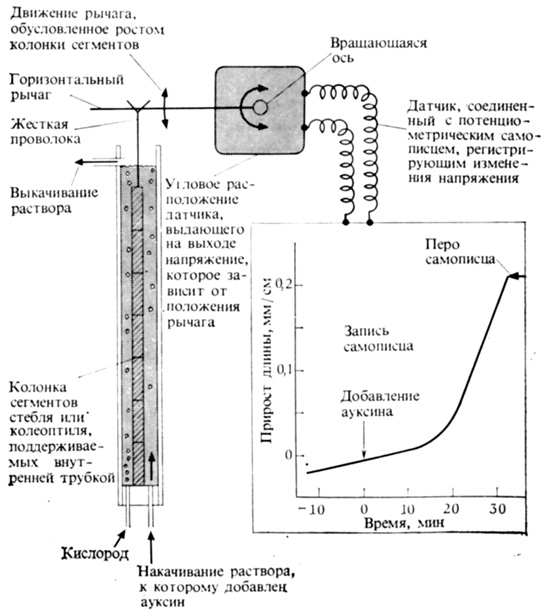
Рис. 9.16. Прибор для регистрации быстрых изменений роста с типичной кривой, характеризующей рост после добавления ИУК к буферу с pH около 6,5
Какое же изменение происходит за такой короткий период, что его можно связать с индуцированным ауксином растяжением клеток? Ответ, вероятно, заключен в феномене, впервые обнаруженном в 30-х годах, но не обратившем на себя внимание большинства ученых. Затем он был открыт повторно и описан в начале 70-х годов. Было установлено, что кислая среда (низкий pH) способствует растяжению клеток. Если отрезки стебля или колеоптиля поместить в прибор, изображенный на рис. 9.16, погрузив их в кислый раствор, то их рост усилится. Если для улучшения проникновения кислоты с отрезков снять эпидермис, то оптимальное усиление роста и растяжимости клеточных стенок будет наблюдаться при pH около 5. Если мертвые отрезки растянуть механически, то усилие, которое необходимо приложить, чтобы достигнуть определенной степени растяжения, будет меньше в том случае, когда отрезки погружены в раствор с pH 3,5, а не с pH 7,0. Таким образом, влияние кислоты на растяжение не требует наличия метаболически активных клеток. Растяжение клеток является прямым следствием действия ионов H+ на компоненты стенки. О связи между кислотой и ауксином свидетельствует то, что они оказывают сходное влияние на рост. Различаются же они тем, что, во-первых, кислота действует на стенки, а ауксин - на клетки и, во-вторых, влияние кислоты длится лишь короткое время, а влияние ауксина - по меньшей мере несколько часов. Между кислотой и ауксином, возможно, существует простая зависимость. Если под влиянием ауксина происходит подкисление клеточных стенок, то это может вызвать их последующее разрыхление. Этот механизм объясняет лишь первоначальную стимуляцию роста, так как материалы, необходимые для дальнейшего растяжения клеток, быстро исчерпываются. Чтобы рост мог продолжаться, ауксин должен проявить еще одно действие, которое обеспечило бы синтез новой стенки. Именно этот последний процесс отсутствует, когда растяжение стенки индуцируется только одной кислотой.
Известно, что в клеточных мембранах и в мембранах различных органелл клетки имеются метаболические насосы для разнообразных веществ, таких, как минеральные ионы, сахароза, гормоны и ионы водорода (см. гл. 7). Согласно одной широко распространенной теории, ауксин стимулирует работу локализованного в плазмалемме насоса, перекачивающего ионы H+ из цитоплазмы в клеточную стенку. Такие насосы представляют собой белки, получающие энергию для своей работы в результате расщепления АТР до ADP и неорганического фосфата. Ресинтез АТР зависит, конечно, от метаболизма. Эта теория предполагает, что насос, перекачивающий ионы H+, функционирует лишь в том случае, если с ним связана ИУК, действующая как эффектор (активатор) (рис. 9.17). Такая связь, по-видимому, обратима. Она образуется и распадается в зависимости от концентрации ИУК в окружающей цитоплазме. Эта модель в основном подтвердилась, когда было показано, что отрезки колеоптиля со снятым эпидермисом при помещении их в раствор подкисляют его только после добавления ИУК в среду. Таким образом, несмотря на то что теория активируемого ауксином протонного (H+) насоса не разрешила всех проблем и ее необходимо дополнить некоторыми деталями, она согласуется с большинством данных и представляет собой приемлемое объяснение действия ауксина на растяжение клеток.
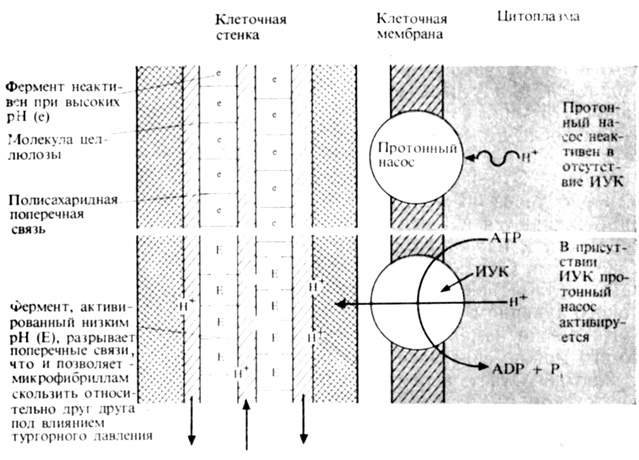
Рис 9.17. Теория протонного насоса, объясняющая действие ИУК на растяжимость стенки и растяжение клетки
Но мы еще не закончили. Почему подкисление способствует растяжению клеточных стенок? Чтобы ответить на этот вопрос, мы должны вернуться к структуре клеточной стенки растения (рис. 2.31). Стенка состоит из длинных молекул целлюлозы, связанных между собой полисахаридными мостиками, образованными смесью сахаров, таких, как галактоза, арабиноза и ксилоза. Полисахаридные мостики, составляющие часть стенки, обычно называют гемицеллюлозой. Длинные целлюлозные молекулы, соединенные друг с другом этими поперечными связями, обусловливают жесткость клеточной стенки. При необратимом растяжении клеточной стенки, что происходит обычно в процессе роста, целлюлозные цепи должны скользить относительно друг друга, и это может быть достигнуто только в том случае, если поперечные связи между цепями целлюлозы будут разорваны. Когда растяжение стенки завершается, поперечные связи образуются вновь, фиксируя целлюлозные цепи в их новом положении (рис. 9.18). В результате размеры клетки увеличиваются. Чтобы кислота могла способствовать увеличению растяжимости стенки, она, очевидно, должна разрывать поперечные связи между молекулами целлюлозы. Было высказано предположение, что в клеточной стенке имеется pH-зависимый фермент, разрушающий такие связи. Этот фермент не действует при pH 6,0-7,0, но становится высокоактивным при pH около 5,0. Когда под влиянием ауксина, присутствующего внутри клетки, ионы H+ накачиваются в клеточную стенку, фермент активируется и разрушает поперечные связи; целлюлозные цепи освобождаются и получают возможность скользить одна относительно другой. Такое скольжение осуществляется под действием тургорного давления клеточного содержимого, что вызывает растяжение стенки и увеличение размеров клетки. Мы еще не знаем природу этого гипотетического фермента, о существовании которого свидетельствует то, что некоторые химические соединения, препятствующие обычно действию ферментов, способны ингибировать индуцированное кислотой растяжение стенок изолированных клеток.
В отсутствие ауксина индуцированный кислотой рост длится лишь короткий период, а в его присутствии продолжается в течение многих часов. Что же собой представляет этот долговременный процесс, активируемый ауксином? Если добавить ингибитор синтеза белка (такой, как циклогексимид) к стимулированным ауксином отрезкам стебля, то они прекращают рост примерно через 15 мин после остановки синтеза белка. Если же ингибитор добавляется задолго до нанесения ауксина, то последний все же стимулирует рост, но лишь в течение тех же 15 мин. Отсюда мы можем заключить, что первоначальная стимуляция роста, обусловленная выкачиванием ионов H+ из цитоплазмы под влиянием ауксина, не зависит от синтеза белка, тогда как дальнейший индуцированный ауксином рост нуждается в синтезе белка. Одним из необходимых белков является, по-видимому, сам белок, выполняющий функцию насоса, так как в присутствии циклогексимида индуцированное ауксином подкисление наружной среды прекращается. Следовательно, в присутствии ауксина этот белокннасос должен иметь довольно короткое время жизни и постоянно синтезироваться. Для продолжения роста необходимы также и другие процессы. Чтобы удержать стенку клетки в растянутом состоянии и сделать ее жесткой, нужно перестроить полисахаридные поперечные связи* Затем, чтобы предотвратить постепенное утончение стенки (известно, что ее толщина в течение всего периода роста клетки остается примерно одинаковой), должно синтезироваться больше целлюлозы и полисахаридов, образующих поперечные связи. Так, примечательно, что ауксин, как было установлено, повышает активность ферментов, ответственных за синтез целлюлозы. Эти ферменты локализованы в клеточной мембране и в пузырьках диктиосом, которые, как известно, участвуют в синтезе компонентов стенки.

Рис. 9.18. Возможный механизм растяжения клеточной стенки под влиянием ауксина
Для непрерывного деления, растяжения и дифференциации клеток под влиянием ауксина необходим постоянный синтез новых белков. В период роста клетки белки используются для построения дополнительных компонентов цитоплазмы клетки, а при дифференциации требуются новые ферменты, участвующие в процессах, характерных только для дифференцированного состояния клетки. Было показано, что ауксин вызывает увеличение скорости синтеза белка путем повышения синтеза мРНК в ядре. Совместно с другими гормонами и регуляторами ауксин, вероятно, изменяет также тип образующейся мРНК, изменяя тем самым тип ферментов в жлетке. В результате синтезируется больше ферментов, специфических в отношении роста и дифференциации клеток. Кроме того, синтезируется больше рибосомной РНК, чтобы удовлетворить повышенную потребность в ней, возникающую при синтезе белка. Мы еще не знаем, какие ферменты, синтезируемые под влиянием ауксина, индуцируют продолжительный рост клеток и их дифференциацию. Такие проблемы с трудом поддаются решению, однако постепенно мы будем все больше узнавать о деталях, связанных с ростом и дифференциацией клеток, и в конце концов сможем лучше представить себе, где следует искать ответы на нерешенные вопросы.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'