
Поглощение минеральных веществ из почвы и транспорт ионов через клеточные мембраны
Теперь, когда мы рассмотрели минеральные элементы, необходимые для нормального роста растений, следует обсудить, как они поступают в растение из внешнего мира. Минеральные вещества обычно поглощаются из почвы с помощью корней. Поскольку они могут поступать в небольших количествах также и через листья, внекорневое внесение некоторых микроэлементов стало стандартным сельскохозяйственным методом. Минеральные вещества почти всегда поглощаются растением в форме ионов. Эти ионы должны сначала пересечь плазмалемму, чтобы проникнуть в цитоплазму, а затем и мембрану, окружающую вакуоль или какую-либо клеточную органеллу, с тем чтобы попасть в тот или иной внутренний компартмент цитоплазмы.
Диффузия
Ианы могут проникать через мембрану пассивно или активно, что, вероятно, происходит в разных участках мембраны. Ионы, диффундирующие через мембрану в том и другом направлении, перемещаются благодаря своей собственной кинетической энергии, не потребляя в этом процессе ни АТР, ни другие богатые энергией соединения. Способность некоторых видов молекул проникать через клеточные мембраны связана с их растворимостью в липидах. Поскольку мелкие липидорастворимые молекулы проходят через мембраны быстрее, чем более крупные, участки, через которые происходит такое перемещение, очевидно, лучше всего можно представить в виде маленьких липидных каналов, пересекающих мембрану. Хотя неорганические ионы не растворяются в липидах, они тоже могут проникать через мембрану. В последнее время получены данные, позволяющие предполагать, что неорганические ионы проходят через мембрану по водным белковым каналам, получившим название пермеаз.
Одни ионы диффундируют через мембрану значительно быстрее чем другие, что свидетельствует о ионной специфичности пермеаз. Коэффициент проницаемости P описывает относительную способность различных ионов диффундировать через мембрану при сравнимых стандартных градиентах. Так как большинство мембран более проницаемо для K+, чем для других ионов, значение P для K+ условно принято за 1,0. В гигантских клетках водоросли Nitella коэффициенты проницаемости для Na+ и Cl- равны соответственно 0,18 и 0,033. Из бактерий и гримов были выделены полипептиды и белки, способные образовывать соответствующие каналы для определенных ионов. Такие вещества, названные ионофорами, при добавлении к искусственным липидным мембранам вызывают увеличение скорости диффузии данного иона в миллион раз. Поскольку подобные соединения нарушают нормальную избирательную проницаемость мембран, они могут выступать в качестве антибиотиков, убивая определенные виды клеток. Антибиотик грамицидин, рассмотренный раньше, относится к соединениям этого типа.
Происхождение и роль трансмембранного потенциала в транспорте ионов
Так как все ионы заряжены, скорость их диффузии и распределения в равновесном состоянии определяется не только проницаемостью мембраны и различиями в концентрации ионов по обе ее стороны (химический потенциал), но также и электрическим потенциалом, возникающим между внутренней и внешней сторонами мембраны. Поэтому мы говорим, что движение ионов обусловлено градиентом электрохимического потенциала. Обычно растительные клетки на внутренней стороне своих мембран имеют отрицательный потенциал, что приводит к преимущественному поглощению катионов (+) по сравнению с анионами (-). Необходимо более детально обсудить этот потенциал.
Если разделить мембраной растворы с разной концентрацией свободно диффундирующих ионов, то между двумя ее сторонами возникнет напряжение, называемое трансмембранным потенциалом. Его можно измерить с помощью двух микроэлектродов соединенных с чувствительным вольтметром. Один электрод, сделанный из стеклянного капилляра с диаметром приблизительно 1 мкм, вводится через клеточную стенку и плазмалемму внутрь клетки, а другой, электрод сравнения, располагается вне клетки (рис. 7.8). В клетках с большой центральной вакуолью внутренний электрод обычно проникает не только через плазмалемму, но и через тонопласт, так что измеряемые величины: представляют собой разность потенциалов между вакуолью и клеточным окружением. Подобные измерения показывают, что разность потенциалов колеблется от 50 до 200 мВ, причем содержимое клетки характеризуется более отрицательным зарядом.
Трансмембранный потенциал частично обусловлен избирательной проницаемостью клеточной мембраны, что ограничивает- скорость движения одного иона относительно другого. K+, например, может проникать через мембрану значительно быстрее, чем Cl-. Если оба этих иона внутри клетки имеют более высокую концентрацию, чем вокруг нее, то более быстрая нетто-диффузия ионов K+ наружу по градиенту концентрации в конечном! итоге приведет к возникновению более высокого отрицательного заряда внутри клетки, так как там останется избыточное количество Cl-.
Активный транспорт (прокачивание ионов через мембрану) представляет собой, вероятно, самый важный регулятор трансмембранного потенциала. Некоторые детали этого процесса мы обсудим позже. Вначале рассмотрим последствия активного транспорта ионов какого-либо одного типа только в одном направлении. Такой процесс называется электрогенным, так как ведет к накапливанию отрицательных зарядов на одной стороне мембраны и положительных - на другой. Одним из главных ионов, участвующих в создании трансмембранного потенциала, является H+. При откачивании H+ из клетки внутри нее возникает отрицательный потенциал.
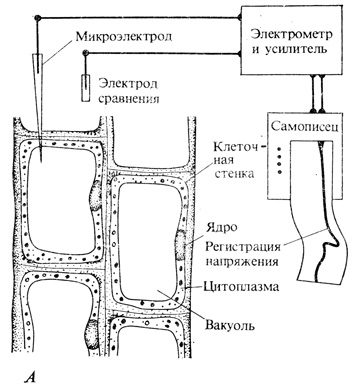
Рис. 7.8. А. Устройство, используемое для измерения трансмембранного потенциала растительных клеток. Обратите внимание, что микроэлектрод с суженным концом проникает в вакуоль, тогда как более крупный электрод сравнения находится в растворе, омывающем ткань. Ионы могут свободно диффундировать между омывающим раствором и клеточными стенками. (С любезного разрешения R. Racusen, University of Maryland.)
Возникнув однажды, трансмембранный потенциал в свою очередь может влиять на последующее движение ионов. Предположим, например, что трансмембранный потенциал клетки составляет - 166 мВ, причем внутреннее содержимое клетки заряжено отрицательно. Этот внутриклеточный отрицательиый потенциал вызывает диффузию в клетку положительно заряженных ионов, таких, как К+. Одновременно будет подавлено поступление отрицательно заряженных ионов, например Сl-. Количественную зависимость между трансмембранным потенциалом и диффузионными потоками какого-либо иона, например К+, можно рассчитать по формуле, называемой уравнением Нернста (см. ниже).
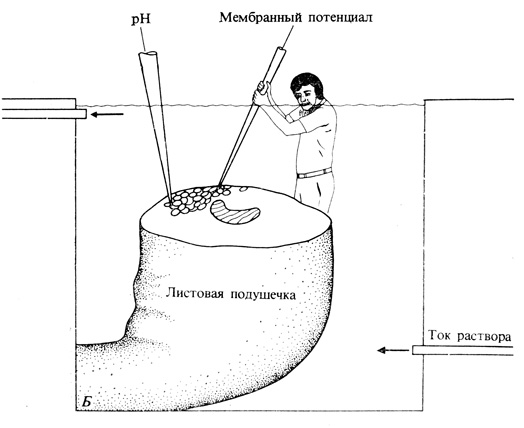
Б. Электрофизиолог Ричард Ракусен 'демонстрирует' использование микроэлектродов для измерения внутреннего потенциала и внешнего pH клетки листовой подушечки у Samanea saman. Стеклянный электрод для измерения pH, проницаемый для ионов H+, является микрокопией электрода обыкновенного pH-метра
Некоторые незаряженные молекулы, такие, как сахароза, проникают через мембрану вместе с тем или иным ионом, обычно H+. Этот (процесс, называемый котранспортом или симпортом, играет особенно важную роль в регуляции движения сахарозы во флоэму и из нее (см. гл. 8).
Поступление в клетки флоэмы комплекса H+ - сахароза ("загрузка") и его выделение из клеток флоэмы ("разгрузка"), вероятно, происходят путем перемещения молекул через мембрану с участием пермеазы. Незаряженные молекулы сахарозы "проталкиваются" через пермеазу ионами H+, причем направление нетто-диффузии определяется электрохимическим градиентом H+.
Уравнение Нернста связывает электрический потенциал внутри клетки с распределением заряженных ионов:
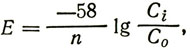
где E - трансмембранный потенциал (мВ), измеренный с использованием заземленного электрода вне клетки;
n - валентность и заряд иона;
Ci - концентрация (молярность) иона внутри клетки;
Co - концентрация (молярность) иона вне клетки.
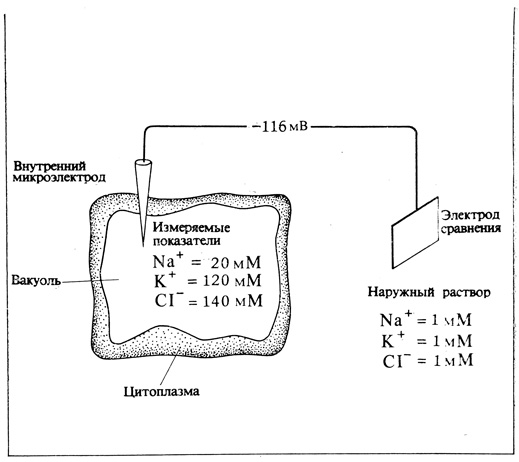
Предположим, что E = -116 мВ. Для одновалентных катионов, например Na+ или K+, n=1 и lg Ci/Co = -116/-58 = 2. Так как 2 - это lg100, K+ и Na+ будут диффундировать в клетку без затраты метаболической энергии до тех пор, пока внутренняя концентрация каждого иона не будет равна 102, или 100 X наружная концентрация. С другой стороны, диффузия одновалентного аниона, например Cl-, приведет к тому, что его внутренняя концентрация будет составлять лишь 10-2, или 0,01 X внешняя концентрация.
Типичные величины трансмембранного потенциала и концентрации K+, Na+ и Cl- внутри вакуоли клетки высшего растения показаны ниже. Концентрация Na+ внутри клетки меньше величины, рассчитанной по уравнению Нернста, а концентрация
K+ и Cl- - больше. Очевидно, Na+ активно транспортируется из клетки, а K+ и Cl- - в клетку. K+ - единственный элемент, фактическая концентрация которого близка к рассчитанной по уравнению Нернста.
Активный транспорт ионов
Кроме диффузии ионов, осуществляемой через определенные участки мембраны благодаря градиенту электрохимического потенциала, ионы перемещаются также через специфические зоны мембраны, называемые насосами, с затратой энергии, запасенной обычно в форме АТР. Таким образом, в отличие от диффузии, которая происходит лишь по градиенту электрохимического потенциала, активный транспорт с использованием насосов состоит в переносе ионов против этого градиента.
Выше уже обсуждалось, что при активном транспорте какого-то одного иона в одном направлении трансмембранный потенциал изменяется. Однако активный транспорт не обязательно должен быть электрогенным. Движение двух ионов с одинаковым зарядом (например, K+ и H+) в противоположных направлениях или двух ионов с одинаковыми по величине, но разными по знаку зарядами (например, K+ и Cl-) в одном направлении представляет собой электронейтральный процесс, так как баланс катионов и анионов по обе стороны мембраны при этом не изменяется (рис. 7.9). В корнях ионы H+ часто обмениваются на K+. K+ поглощается из почвенного раствора или с поверхности почвенных частиц, на которых он адсорбируется. В результате одновременного экспорта ионов H+ внешний раствор становится более кислым, что может способствовать распаду почвенных частиц. Аналогичным образом поглощение анионов, например NO3-, уравновешивается выделением бикарбоната (HCO3-) или органических анионов, таких, как малат.
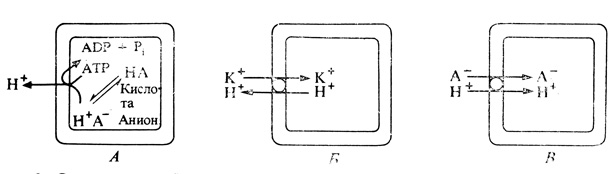
Рис. 7.9. Электрогенный и электронейтральный транспорт ионов. А. Электрогенная секреция H+ повышает электроотрицательность клеточного содержимого по сравнению с внеклеточным пространством. Б. Выделение H+ компенсируется поглощением K+. В. Выделение H+ компенсируется выделением аниона
Для того чтобы экспериментально установить, перемещаются ли ионы через мембрану путем диффузии или с помощью активного транспорта, используют вещества, ингибирующие синтез АТР. Самые простые опыты такого типа проводят в темноте. При этом фосфорилирование в хлоропластах прекращается, и митохондрии становятся главными центрами синтеза АТР. Затем к клеткам добавляют метаболические яды, такие, как 2,4-динитрофенол, азид натрия, цианид натрия или ж-хлоркарбонилцианидфенилгидразон, препятствующие синтезу АТР в митохондриях. (При проведении подобных экспериментов на свету для предотвращения фотофосфорилирования в хлоропластах необходимо применять дополнительные ингибиторы, например диурон.) Если обработать растение эффективным ингибитором в соответствующей концентрации, активный транспорт прекратится, как только растение израсходует запасы АТР. Диффузия ионов, по-видимому, будет продолжаться, однако ее доля, обусловленная генерацией электрического потенциала путем активных процессов, будет снижена. Аналогичные результаты можно получить также и в темноте в атмосфере без O2, так как в анаэробных условиях окислительное фосфорилирование в митохондриях осуществляется крайне неэффективно. Анаэробные условия в корнеобитаемой зоне растений, выращиваемых на затопленной почве, могут снижать их способность поглощать ионы, что, вероятно, приводит к недостаточному снабжению растений минеральными веществами.
Опыты с изолированными корнями, помещенными в солевые растворы, помогли физиологам понять, как функционируют ионные насосы при поглощении солей. Скорость поглощения определенного элемента, который используют обычно в виде радиоактивного изотопа, измеряют при разных концентрациях других элементов в растворе. Типичный опыт на корнях овса показывает, что при повышении концентрации K+ с 0 до 0,02 мМ скорость его поглощения увеличивается линейно, а затем этот прирост становится более медленным по мере того, как концентрация K+ приближается к 0,20 мМ (рис. 7.10,Ф). Большинство других ионов поглощается медленнее, чем K+, тем не менее кривые их поглощения похожи на кривую, полученную для K+. Особый интерес представляет то, что кривые поглощения ионов имеют сходство с графиками, характеризующими зависимость скорости ферментативных реакций от концентрации субстрата (см. рис. 2.16). Поэтому возможно, что мембранные белки функционируют как ферменты, облегчающие движение ионов через мембрану. При этом скорость поглощения определенного иона достигает своего максимума тогда, когда все центры переноса в этих белках, предназначенные для данного иона, оказываются занятыми.
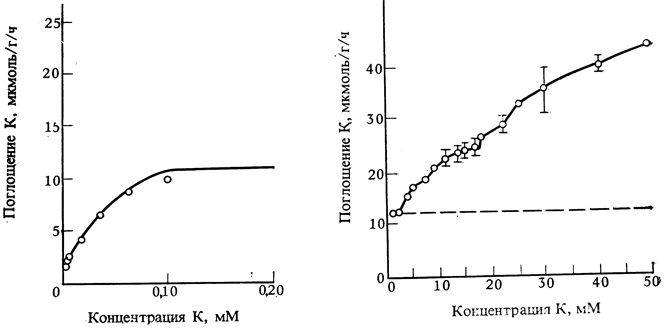
Рис. 7.10. Скорость поглощения калия корнями ячменя как функция концентрации KCl в растворе. Концентрация Ca равна 0,5 мМ. Низкая (А) и более высокая (Б) концентрация KCl. (Epstein et al. 1963. Proc. Nat. Acad. Sci., 49, 684-692; Epstein, Rains. 1965. Proc. Nat. Acad. Sci., 53, 1320-1924.)
Когда концентрация KCl во внешней среде становится выше первого "уровня насыщения" - от 1 до 50 мМ (рис. 7.10,5), скорость поглощения K+ вновь возрастает. Однако при таких высоких концентрациях соли специфичность для иона K+ снижается, так как его поглощение может изменяться под влиянием самых разнообразных ионов. Пока не установлено, участвуют ли в поглощении ионов K+ многие переносчики разных типов (один из них специфичен для иона K+, а другие имеют активные центры, которые могут быть заняты несколькими различными катионами) или за все фазы поглощения К+ отвечает один переносчик.
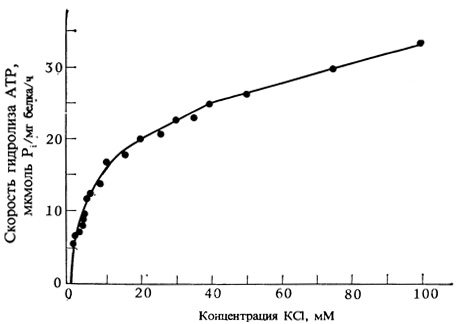
Рис. 7.11. Влияние KCl на гидролиз АТР до ADP+Pi измеряли в обогащенной плазматическими мембранами фракции, полученной из корней овса. Мембранная фракция была приготовлена по схеме, приведенной на рис. 2.1. Реакционная смесь содержала АТР, MgSO4 и KCl, pH 6,5. При выделении Pi образуется окрашенное вещество, измеряемое спектрофотометрически. (Leonard, Hodges. 1973. Plant Physiol., 52, 6-12, с изменениями.)
На плазмалемме клеток корня овса недавно был обнаружен фермент, способствующий гидролизу АТР до ADP и Pi в присутствии K+. Помимо того что активность этой ATP-азы повышается при наличии K+ в среде (рис. 7.11), зависимость такого эффекта от концентрации K+ имеет поразительное сходство с графиком поглощения К+ интактными корнями овса (ср. с рис. 7.10). Очевидно, этот фермент действует как переносчик, использующий для транспорта ионов K+ через плазмалемму энергию, образующуюся при распаде АТР. Хотя детали механизма активного транспорта остаются в основном невыясненными, имеющиеся данные позволяют предполагать, что мембранный белок-переносчик вначале связывается со своим специфическим ионом, а затем изменяет свою конфигурацию под влиянием АТР. Когда же переносчик в конце концов расщепляет АТР, его конфигурация возвращается в первоначальное состояние и ион высвобождается, но уже на противоположной стороне мембраны (рис. 7.12).
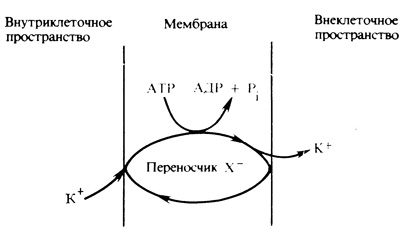
Рис. 7.12. Гипотеза 'переносчика', объясняющая поглощение ионов клетками корней. Белок X-, присутствующий в плазмалемме, образует комплекс с K+ на наружной стороне мембраны. Этот комплекс перемещает K+ через мембрану и вводит его в цитоплазму, используя энергию, освобождающуюся при гидролизе АТР до ADP+Pi. Затем переносчик подхватывает другой ион K+
Взаимодействие и антагонизм ионов
Некоторые ионы могут влиять на поглощение и транспорт других ионов (рис. 7.13). Например, повышение концентрации Rb+ во внешнем растворе снижает поглощение K+, и наоборот; Cl- и Br- также действуют как взаимные антагонисты. Наличие Na+, напротив, оказывает незначительное влияние на поглощение Rb+, но снижает поглощение Li+. По-видимому, определенные группы ионов "конкурируют" за специфические участки локализованного в мембране переносчика. Эти участки, очевидно, соответствуют геометрии конкурирующих ионов.
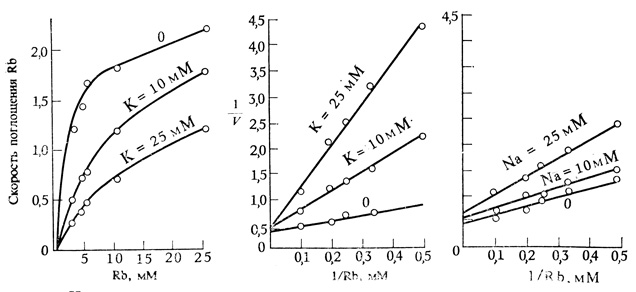
Рис. 7.13. Конкурентное влияние K+ и Na+ на поглощение Rb+. Слева - обычный график; справа - графики зависимости величин, обратных скорости поглощения Rb+, от величины, обратной концентрации Rb+. Такие графики, построенные по методу двойных обратных величин, в случае ферментативных реакций обычно дают прямые линии (см. рис. 2.17). Видно, что K+ оказывает конкурентное влияние на поглощение Rb+, тогда как Na+ проявляет лишь незначительный эффект. (Epstein, Hagan. 1952. Plant Physiol., 27, 457-474, с изменениями.)
Иногда поглощение того или иного иона может предотвратить вредные влияния, обусловленные избыточным поглощением другого иона. Например, К+ и другие одновалентные катионы имеют тенденцию уменьшать вязкость цитоплазмы и увеличивать текучесть и проницаемость мембран, тогда как двухвалентные катионы, например Ca2+, оказывают противоположное влияние. Из-за таких взаимодействий, названных антагонизмом ионов, для корректировки дефицита отдельных минеральных веществ под растения обычно вносят смеси солевых растворов, а не отдельные соли.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'