
Фиксация азота
Одной из важнейших задач биохимиков, заинтересованных в увеличении продуктивности сельского хозяйства, является повышение эффективности азотфиксации, так как рост растений чаще всего лимитирует недостаточное снабжение их фиксированным азотом. Азот в форме стабильной молекулы N2 составляет 80% атмосферы. Перед фиксацией (восстановлением азота до аммиака) эта молекула должна каким-то образом дестабилизироваться и расщепиться. Образующийся при фиксации аммиак (NH3) может поглощаться корнями растений как таковой или после его окисления почвенными микроорганизмами до нитратов (NO3-). В большинстве почв образование NO3- из NH3 происходит настолько быстро, что большая часть азота поглощается корнями в виде NO3-.
Фиксация азота осуществляется главным образом некоторыми свободно живущими бактериями, потребляющими органическое вещество почвы. К ним относятся, например, аэробная форма Azoiobacter и анаэробная - Clostridium. Бактерии рода Rhizobium, которые тоже участвуют в фиксации азота, живут в корневых опухолях или клубеньках определенных видов растений (рис. 7.3). Растение-хозяин принадлежит обычно к семейству бобовых, включающему горох, бобы, сою, люцерну* клевер и вику. Недавно проведенные исследования показали, что азотфиксирующие бактерии рода Spirillum окружают корни тропической травы Digitaria. Эта слабая ассоциация корней травы и бактерий в ризосфере, возможно, представляет промежуточную эволюционную стадию между свободноживущим азотобактером и локализованным в клубеньках ризобиумом. Растение "привлекает" бактерии с помощью органических корневых выделений. Микроорганизмы ризосферы в свою очередь снабжают растения фиксированным азотом. Некоторые сине-зеленые водоросли (такие, как Anabaena и Nostoc) и фотосинтезирующие бактерии (Rhodospirillum) могут фиксировать атмосферный азот, энергетически сопрягая этот процесс с фотосинтезом. Указанные организмы являются наиболее выраженными автотрофами биологического мира, хотя некоторые штаммы Anabaena живут и эффективно фиксируют азот лишь в ассоциации с особыми "карманчиками" водяного папоротника Azolla. Причины этого явления не выяснены.
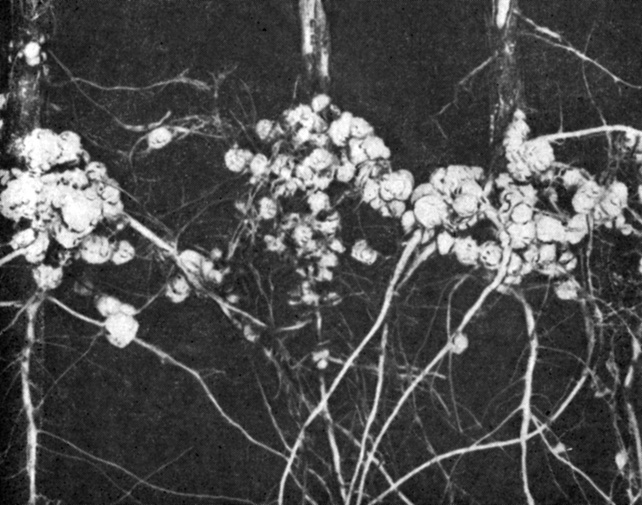
Рис. 7.3. Клубеньки на корнях сои. (С любезного разрешения компании по производству нитрагина.)
Взаимовыгодная ассоциация двух организмов называется симбиозом. Так как ни Rhizobium, ни растение-хозяин в отдельности не способны фиксировать и восстанавливать атмосферный азот, биологический комплекс в клубеньке нужно рассматривать как симбиотическую ассоциацию бактерий и растения-хозяина. Каждый тип растения-хозяина имеет свой собственный симбиотический Rhizobium. Взаимное узнавание растения-хозяина и бактерий осуществляется путем прикрепления особого белка (лектина), находящегося на поверхности клеток корневого волоска, к специфической бактерии. После прикрепления к хозяину вторгающийся организм проникает в клетки необычно искривленных корневых волосков, которые, очевидно, деформируются под влиянием выделяемых бактериями ростовых гормонов группы ауксина (см. гл. 9). Внутри клетки-хозяина бактерии делятся, и образовавшееся потомство изменяет свою форму превращаясь в бактероиды, содержащиеся в инфекционной нити, которая проходит от верхушки клеточной стенки корневого волоска через центр клетки (рис. 7.4). Окончательным результатом такого проникновения бактерий является чрезвычайно сильное разрастание клеток корня, приводящее к образованию бородавчатых выпуклостей, называемых клубеньками. Ризобиум способен эффективно фиксировать азот, лишь находясь в клубеньках такого типа.
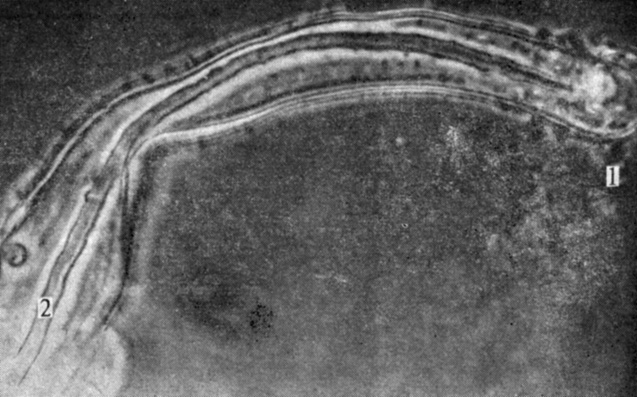
Рис. 7.4. Заражение белого клевера бактериями Rhizobium trifolii происходит через клетки корневых волосков. Обратите внимание на значительное накопление клеток ризобиума (1) на кончике корневого волоска и преломляющую свет инфекционную нить (2) внутри корневого волоска. Отдельные бактериальные клетки своими концами прикреплены к продольным сторонам клеточной стенки корневого волоска. (С любезного разрешения F. B. Dazzo, Michigan State University.)
Ассоциация между Spirillum и его растением-хозяином тоже относится к симбиотической, но она ограничена поверхностью корней. Это менее прочный тип ассоциации, так как Spirillum можно выращивать отдельно от хозяина при наличии достаточного количества питательных веществ. Поэтому ученые изучают возможность крупномасштабного культивирования этих бактерий в качестве источников фиксированного азота. Было также показано, что иногда данные бактерии живут в ассоциации с кукурузой. Это открывает возможность выведения штаммов, способных к фиксации азота на тех видах растений, которые обычно не имеют азотфиксирующих бактерий.
Фиксация азота осуществляется Fe2+- и Mo--содержащим ферментом нитрогеназой. Растения, живущие в ассоциации с азотфиксирующими бактериями и зависящие от этого фермента, не реагируют на добавление азотсодержащих удобрений, так как аммиак (NH3), присутствующий в них или образованный из внесенного азотсодержащего материала, подавляет активность генов, управляющих синтезом нитрогеназы. Поэтому попытки повысить уровень азотфиксации включают поиски азотфиксирующих бактерий, лишенных способности регулировать синтез нитрогеназы по принципу "обратной связи". В регулируемый механизм, очевидно, вовлечен фермент глутаминсинтетаза, поскольку синтез нитрогеназы происходит лишь при высоком содержании глутаминсинтетазы. Недавно были найдены мутантные бактерии, содержащие большое количество глутаминсинтетазы. Они продолжают синтезировать нитрогеназу даже в присутствии NH3. Таким образом, поиск бактерий с высокой эффективностью азотфиксации кажется многообещающим.
Кроме нитрогеназы, которая связывается с молекулой N2 и дестабилизирует ее, для восстановления N2 до NH3 необходимы сильный восстановитель и АТР. Ферредоксин - переносчик электронов, участвующий также и в фотосинтезе, - служит главным восстанавливающим агентом. При симбиотической азотфиксации АТР поставляется растением-хозяином и количество фиксированного азота часто ограничивается скоростью фотосинтеза. Поэтому "удобряя" растение, например сою, двуокисью углерода, в принципе можно повысить общую фиксацию азота благодаря увеличению количества метаболитов, образующихся при фотосинтезе. Однако это трудно осуществить на практике при возделывании полевых культур.
Все азотфиксирующие системы можно отравить даже следовыми количествами кислорода. Это означает, что фермент нитро- геназа даже в аэробных клетках должен содержаться в основном в анаэробных условиях. В корневых клубеньках бобовых это достигается с помощью леггемоглобина (LHb) - красноватого железосодержащего аналога животного пигмента. Подобно гемоглобину крови и миоглобину мышц, леггемоглобин может связываться с кислородом:
LHb+O2⇔LHb•O2.
Такое связывание обеспечивает эффективное удаление кислорода, находящегося поблизости от нитрогеназы, и оптимальные скорости азотфиксации. Кислород, связанный с леггемоглобином, может быть также использован для образования АТР в процессе дыхания. Это имеет очень большое значение, так как для фиксации азота необходимы значительные количества АТР. Как правило, чем краснее клубенек, тем активнее в нем идут процессы азотфиксации. В азотфиксирующей сине-зеленой водоросли Nostoc нитрогеназа. очевидно, локализована в гетероцистах, специальных нефотосинтезирующих анаэробных клетках (рис. 7.5). Эта структурная организация служит также для изоляции азотфиксирующей системы от кислорода, выделяющегося в процессе фотосинтеза.
Некоторые микроорганизмы, обитающие в почве, могут окислять аммиак (NH3) до нитратов (NO3-). Большинство растений предпочитают поглощать и использовать азот, внесенный в виде нитрата, хотя такой азот в итоге включается в растительный материал в форме высоковосстановленных аминогрупп (-NH2). Фермент нитратредуктаза восстанавливает нитраты обратно до аммония с помощью восстановленных дыхательных переносчиков, таких, KaKNADPH. Нитратредуктаза, вероятно, содержит молибден в своем активном центре, и это, возможно, является главной метаболической ролью молибдена в растениях. Восстановление NO3- до NH3 может, очевидно, происходить через такие промежуточные соединения, как азотистая кислота (HONO) и гидроксиламин NH2OH).
Аммиак токсичен для растительных клеток, поэтому он не должен накапливаться в них в больших количествах. Аммиак обычно превращается в аминокислоты, вступая в реакцию α-кетоглутаровой кислотой (метаболит цикла Кребса), в результате чего образуется глутаминовая кислота, а при дальнейшем добавлении аммиака - глутамин, амид глутаминовой кислоты (рис. 7.6). Другие аминокислоты синтезируются в ходе ферментативного процесса переаминирования, при котором глутаминовая кислота взаимодействует с другими кетокислотами, предшественниками новых аминокислот, перенося на них свою аминогруппу и превращаясь вновь в α-кетоглутаровую кислоту. Аспарагиновая кислота является одним из первых продуктов реакции переаминирования. В этом случае рецептором аминогруппы служит щавелевоуксусная кислота. При дополнительном связывании аммиака с аспарагиновой кислотой образуется аспарагин - амид аспарагиновой кислоты. Преимущественно в форме этих четырех компонентов - глутаминовой кислоты, глутамина, аспарагиновой кислоты и аспарагина - и транспортируется фиксированный азот от клеток корня по всему растению*. Некоторые аминокислоты образуются путем модификации углеродного остова пред существующей аминокислоты.
* (В клубеньковых растениях из сем. бобовых главной формой органического азота, двигающегося вверх по ксилеме, являются замещенные производные мочевины (урейды).)
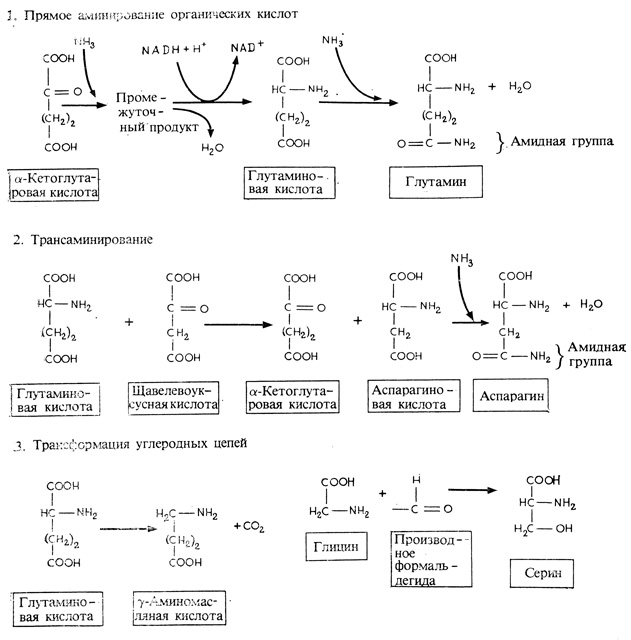
Рис. 7.6. Три способа образования аминокислот
Таким образом, общий круговорот азота в природе представляет собой обратимый переход его свободной газообразной формы в атмосфере в фиксированную форму в почве или биологической системе. В растительных клетках поглощенные нитраты вновь восстанавливаются до аммиака, который затем связывается с определенными органическими кислотами, в результате чего образуются аминокислоты, а затем белки. Эти вещества перевариваются животными и превращаются в животные белки и азотистые продукты обмена - мочевину и мочевую кислоту. В конечном счете все животные и растения отмирают и разлагаются в почве с образованием простых азотистых веществ, таких, как аммиак. Эти вещества постоянно рециркулируют через биологические системы, создавая круговорот азота (рис. 7.7). Благодаря действию денитрифицирующих бактерий фиксированный азот в виде свободного молекулярного азота возвращается в атмосферу, откуда он опять может фиксироваться бактериями. Денитрификация - довольно расточительный процесс.. Его можно теперь замедлить ,в почве с помощью химических соединений, специально предназначенных для этой цели. Их применение должно оказать существенную помощь сельскому хозяйству.
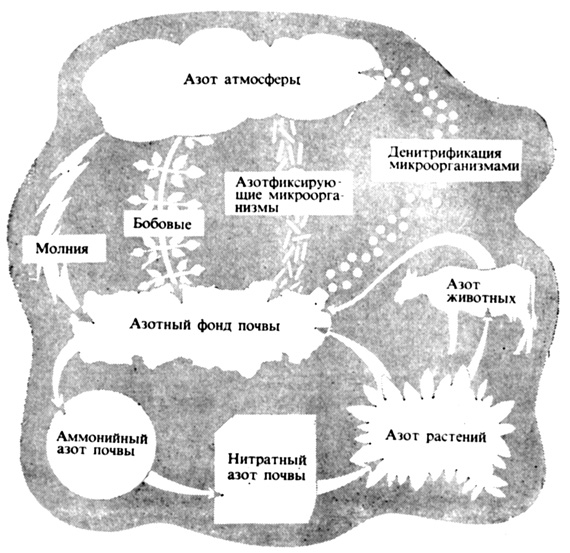
Рис. 7.7. Круговорот азота. Азот почвы, живых существ и атмосферы находится в состоянии постоянного круговорота
Фермент нитрогеназа, который связывается с молекулой N2 (N=N) и восстанавливает ее до аммиака (NH3), может также присоединять ацетилен (HC=CH) и восстанавливать его до этилена (HC=CH). Обнаружение этой активности лежит в основе метода, с помощью которого азотфиксирующую активность растения можно определить непосредственно в поле. Определенное количество ацетилена в виде газа вносится в корнеобитаемую среду растения и через некоторое время удаляется. Количество ацетилена, превращенное в этилен, служит показателем азотфиксирующей способности корней данного растения. Поскольку как ацетилен, так и этилен являются газами, даже незначительные их количества можно анализировать методом газовой хроматографии, позволяющим без больших затрат быстро получать точные данные. Используя этот метод, физиологи растений исследовали азотфиксирующую способность растений сои в онтогенезе и изучили физиологические факторы, влияющие на эффективность процесса. Это важно для выявления путей дальнейшего повышения продуктивности растений.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'