
Вакуоль
Вакуоль - это обширный центральный отдел цитоплазмы,, окруженный избирательно проницаемой мембраной (тонопластом) и заполненный водным раствором солей и органических веществ, а также различными отходами метаболизма. В молодой клетке имеется множество мелких вакуолей, общий объем которых составляет, однако, лишь весьма небольшую долю от объема всей клетки (рис. 2.25). С ростом клетки эти мелкие вакуоли увеличиваются в результате поступления воды (гл. 6) и в конечном счете сливаются в одну большую центральную вакуоль, занимающую иногда свыше 90% общего объема клетки. Центральная вакуоль оказывает давление на цитоплазму и клеточные стенки. Это давление вносит свой вклад в поддержание формы растительного организма и придание ему надлежащей жесткости.
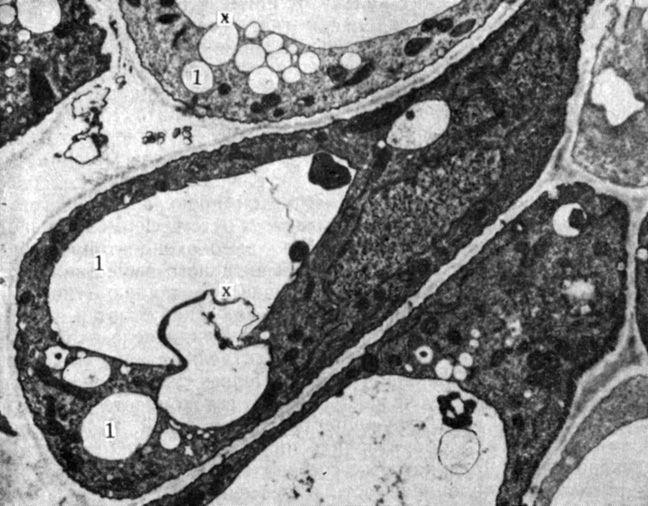
Рис. 2.25. Молодые паренхимные клетки, выращиваемые в культуре. (С любезного разрешения Wilson H. T., University of Alabama at Huntsville.) Эти клетки начали увеличиваться с формированием в цитоплазме одной или нескольких вакуолей (1). В верхней клетке много мелких вакуолей, а в нижней мелкие вакуоли сливаются в одну крупную. Обратите внимание на слияние двух вакуолей на участках, отмеченных крестиком (X): видно, что и мембраны, и цитоплазма между сливающимися вакуолями распадаются
Тонопласт формируется по-разному. Часто он возникает из предобразованных мембран эндоплазматического ретикулума или аппарата Гольджи (последний мы опишем ниже). При определенных условиях тонопласт, по-видимому, образуется в результате ограниченной гидратации одного из участков цитоплазмы с последующим синтезом новой мембраны. На электронных микрофотографиях тонопласт толще плазмалеммы и окрашен более интенсивно. Поскольку вакуоль сильно отличается от цитоплазмы по составу растворенных веществ, следует заключить, что и по характеристикам проницаемости тонопласт и плазмалемма различны. Возможно, что различны также их ионные насосы - присутствующие в мембранах специализированные белки, транспортирующие растворенные вещества через мембранный барьер с использованием энергии АТР. У большей части растений pH (см. ниже) вакуолярного сока колеблется в; пределах 3,5-5,5, но есть и такие виды, у которых он равен 1,0, тогда как pH цитоплазмы близок к 7,0. Столь большая разница в концентрации водородных ионов между вакуолярным соком и цитоплазмой заставляет предположить, что в тонопласте имеются какие-то насосы, перекачивающие ионы H+ из цитоплазмы в вакуоль. По всей вероятности, эти насосы способствуют поддержанию pH цитоплазмы на должном уровне. Такой контроль жизненно важен, поскольку регулирующие метаболизм ферменты сосредоточены главным образом в цитоплазме, а активность ферментов очень сильно зависит от pH. В вакуоли могут, следовательно, храниться и накапливаться ионы и различные вещества, которые в противном случае могли бы нарушить клеточный метаболизм. К таким веществам относятся, в частности, органические кислоты или их соли (часто встречается, например, оксалат кальция), пигменты (такие, как антоцианы) и фенольные соединения (например, таннины).
Все наши современные представления о свойствах тонопласта основываются, во-первых, на результатах ультраструктурных исследований и, во-вторых, на выявлении различий в составе вакуоли и цитоплазмы. Попытки выделить тонопласт из прочих мембранных фракций не имели успеха вплоть до недавнего времени, когда наконец удалось разработать методику отделения интактных вакуолей от остального клеточного содержимого (рис. 2.26). Первый этап этой процедуры сводится к получению сферических протопластов путем ферментативного переваривания клеточных стенок в высококонцентрированном растворе какого-нибудь осмотически активного вещества. Затем протопласты переносят в менее концентрированную (гипотоническую) среду. Здесь они поглощают воду, набухают и в конце концов разрываются, высвобождая вакуоли. После этого дифференциальным центрифугированием отделяют вакуоли от органелл и от инкубационной среды. Первые же анализы таких изолированных вакуолей показали, что в тонопласте сосредоточены ферменты, регулирующие транспорт солей. В настоящее время во многих лабораториях проводятся дополнительные эксперименты, цель которых состоит в том, чтобы определить характеристики проницаемости и ферментный состав тонопласта; такого рода сведения значительно расширили бы наши представления о роли тонопласта в регуляции клеточного метаболизма.
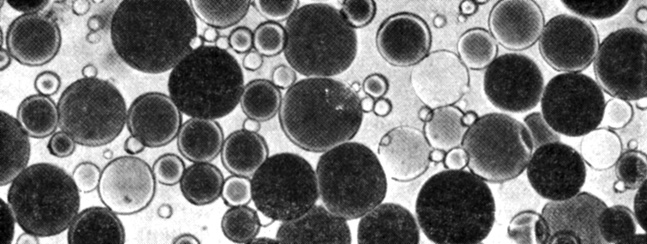
Рис. 2.26. Микрофотография вакуолей, выделенных из двух окрашенных видов Tulipa. (Wagner G. J., Siegelman H. W. 1975. Science, 190, 1200.) Для того чтобы выделить вакуоли, лепестки сначала разрезали бритвенным лезвием на мелкие кусочки. Эти кусочки инкубировали с ферментом, растворяющим клеточные стенки, и таким путем высвободили протопласты. Протопласты в свою очередь инкубировали в растворе, вызывающем их набухание, завершающееся разрывом плазмалеммы. После этого легким помешиванием удалось высвободить из цитоплазмы вакуоли и другие органеллы
Кислотность, pH и буферы
Кислотность и щелочность. Кислотой называют вещество, способное отдавать протон (H+), а основанием - вещество, способное его присоединять. Если добавить к какой-либо водной системе кислоту, то концентрация протонов в системе повысится; если же добавить основание, то оно будет присоединять протоны и тем самым снижать их концентрацию. Это в свою очередь приведет к возрастанию концентрации ионов OH-, потому что при диссоциации воды
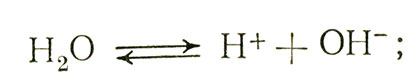
между H+, OH- и H2O поддерживается равновесие.
Таким образом, в водных системах кислотность=[H+], а щелочность=[OH-] (квадратные скобки означают здесь концентрацию в грамм-атомах или грамм-молекулах на литр, т. е. молярность раствора). В водных растворах [H+]X[OH-]=10-14. Поскольку [H+] и [OH-] связаны обратно пропорциональной зависимостью, мы можем, зная [H+], определить [OH-]. В нейтральном растворе (с равными концентрациями ионов водорода и гидроксила) [H+]=[OH-]=10-7 М.
pH. Кислотность клеточного сока колеблется у растений от 10-1 до 10-7 М, т. е. может различаться в миллион раз. При таком большом диапазоне различий для удобства приходится выражать кислотность в логарифмической шкале, через десятичный логарифм концентрации водородных ионов (выраженной в моль/л), взятый с обратным знаком. Для этой величины принято обозначение pH:
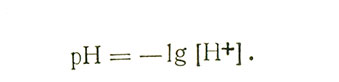
Следовательно, если [H+]=10-x М, то pH=x. Соответственно снижение pH на одну единицу означает десятикратное увеличение кислотности, а повышение на одну единицу - десятикратное ее уменьшение.
Кислотность для растений очень важна, и в частности важна для их роста. Оптимальный для деятельности ферментов - диапазон pH крайне узок - обычно ферменты наиболее активны при значениях pH, близких к нейтральному. В цитоплазме поддерживается pH~7 благодаря буферам (см. ниже), а также насосам, перекачивающим ионы H+ в вакуоль или из вакуоли. Вакуоль у растений служит резервуаром для органических кислот, поэтому pH ее содержимого колеблется обычно в пределах 3,5-5,5; однако в клетках некоторых плодов pH вакуолярного сока равен 1,0. Активность ATP-генерирующих систем в хлоропластах и митохондриях зависит от разности pH между двумя сторонами мембраны, окружающей органеллу (гл. 4 и 5).
Когда биохимики выделяют какие-нибудь органеллы или вещества из растительных клеток, они всегда следят за тем, чтобы экстрагирующая среда была соответствующим образом забуферена (обычно в пределах pH 6-8), т. е. чтобы содержащиеся в клеточных вакуолях кислоты были нейтрализованы, так как в противном случае может произойти денатурация клеточных ферментов. Рост растений в большой степени зависит от pH почвенного раствора, главным образом потому, что именно pH oпределяет доступность находящихся в почве питательных веществ, а крайние значения pH могут обусловливать также и токсические эффекты (оптимальным для роста оказывается обычно pH, близкий к нейтральному; см. гл. 7 и 14).
Титруемая кислотность. Истинную кислотность растительного сока выражают через концентрацию водородных ионов, а титруемую кислотность определяют по количеству щелочи, расходуемой на нейтрализацию сока (на доведение его pH до 7). Предсказать титруемую кислотность по концентрации водородных ионов невозможно, потому что в растительном соке содержатся слабые кислоты, у которых степень диссоциации мала. Истинная кислотность равна титруемой лишь в том случае, если кислота полностью диссоциирована, т. е. если это сильная кислота. По определению
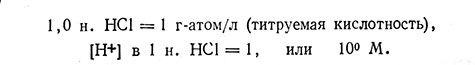
При полной диссоциации 1 н. HCl соответствует pH 0, поскольку -lg 1=0. (В действительности, однако, диссоциация не бывает полной и 1,0 н. HCl соответствует pH 0,10.)
Слабой кислотой называют такую кислоту, у которой диссоциирована лишь небольшая часть молекул. В 1 н. уксусной кислоте (CH3COOH) доля диссоциированных молекул составляет всего 0,42 %.
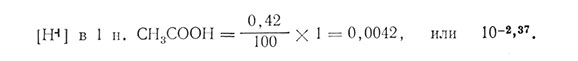
Таким образом, 1 н. CH3COOH, соответствует pH 2,37, поскольку -lg 0,0042=2,37.
Однако, хотя истинная кислотность 1 н. HCl в 200 с лишним раз выше, чем у 1 н. CH3COOH, на титрование равных объемов этих растворов расходуется одно и то же количество щелочи. Дело в том, что, по мере того как щелочь связывает ионы H+ в растворе уксусной кислоты, часть ранее недиссоциированных молекул уксусной кислоты диссоциирует, так что общее количество диссоциированной формы все время поддерживается на уровне 0,42%. Иными словами, количество ионов H+ в растворе непрерывно пополняется, пока все потенциально присутствовавшие в нем ионы H+ не будут связаны щелочью.
Буферы. В растительных клетках содержатся так называемые буферы - смеси веществ, способные поддерживать pH на; постоянном уровне. У слабой кислоты почти все ее титруемые водородные ионы присутствуют в виде потенциальных ионов Н+. Поэтому если приготовить смесь из такой кислоты и какой- нибудь ее соли, то даже при добавлении больших количеств. H+- или OH--ионов pH среды будет оставаться практически постоянным. Подобную смесь называют "буфером" за ее способность предотвращать изменения pH. Для слабой кислоты НА (где А означает любой анион, например ацетат)
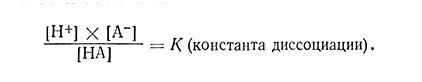
В состоянии равновесия отношение между недиссоциирован- ными молекулами и ионами остается постоянным; у слабой кислоты оно может быть, например, равно 9HA:1H+:1A-. С добавлением того или иного основания равновесие нарушается, так как вводятся ОН~-ионы, связывающие ионы H+. Однако, характерное для равновесия отношение немедленно снова восстанавливается благодаря диссоциации некоторой части молекул НА, запас которых очень велик; поэтому концентрация водородных ионов [H+] остается практически неизменной.
Для того чтобы pH не менялся также и при добавлении ионов H+, буфер должен иметь еще и резерв анионов (A-). С этой целью к нему добавляют соль слабой кислоты, диссоциирующуюся в высокой степени; для NaA, например, отношение недиссоциированных молекул к ионам может быть равно 1 NaA:9Na+:9 A-. Когда кислоту и соль смешивают, устанавливается новое равновесие, но содержание недиссоциированных молекул НА (источник ионов H+, способных соединяться с OH-ионами) и анионов A- (способных соединяться с ионами H+) остается высоким. При равных количествах кислоты и соли pH будет поддерживаться на постоянном уровне. Если, например, добавить одну каплю концентрированной HCl к 1 л воды, то это снизит pH на 3,7 ед; но если то же количество HCl добавить к 1 л буфера, состоящего из 0,1 н. слабой кислоты и ее соли, то добавление HCl практически вообще не окажет влияния на pH. Именно таким образом забуферено содержимое клеточных вакуолей: в нем присутствуют органические кислоты, например лимонная или яблочная, и одновременно соли этих кислот.
Буферы в протоплазме. В протоплазме главными буферами служат белки и аминокислоты, потому что суммарный заряд аминокислот может быть как положительным, так и отрицательным, в зависимости от pH. Добавляемые ионы H+ присоединяются к карбоксильным группам молекулы, а добавляемые чоны OH- соединяются с ионами H+, отщепляющимися от ее аминогрупп. Для того чтобы представить себе это, следует обратиться к общей формуле аминокислот, изображенной на рис. 2.12.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'