
Что такое "флавоноиды"?
Столетья таинства полны, И не исчезнет жизнь, покуда Есть ощущенье новизны, И удивления, и чуда.Расул Гамзатов
Ядовитый родоначальник неядовитых веществ. - Непременные спутники других "жильцов" растительной клетки. - Невидимки среди множества цветов и оттенков. - Две дороги ведут к одной цели. - Какой соперник сильнее? - Главное достоинство флавоноидов.
Бензол... Подвижная бесцветная жидкость со своеобразным запахом... Она известна каждому школьнику, изучающему химию. Попадая на кожу, она вызывает сильное раздражение, а ее пары нарушают нормальную функцию кроветворных органов, поражают центральную нервную систему.
Молекула бензола имеет циклическое строение. Она состоит из шести атомов углерода и шести атомов водорода. При замещении одного водородного атома группой ОН получается новое вещество - фенол, или карболовая кислота:
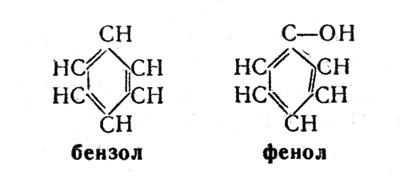
фенол, или карболовая кислота
Полупрозрачные кристаллы фенола, розовеющие при хранении и обладающие резким запахом, хорошо известны также из школьного курса химии. "Будьте осторожны при обращении с фенолом", - предупреждает ребят каждый раз учитель химии. Фенол действительно оказывает губительное действие на организм человека - предельно допустимое его содержание в окружающей среде составляет всего лишь 0,005 мг в расчете на 1 л воздуха.
И бензол, и происходящий от него фенол, таким образом, являются сильными ядами. Они не относятся к природным веществам, а получены в лабораторных условиях. Не встречаясь в растительных клетках, бензол тем не менее явился родоначальником большой группы совершенно безвредных природных соединений - так называемых растительных фенолов (полифенолов). Они названы полифенолами (от греч. "поли" - много) потому, что молекулы их состоят не из одной, как у обычного фенола, а из большего числа фенольных групп. Напомним, что фенольная группа представляет собой не что иное, как шестичленное бензольное кольцо с боковой группой ОН. Поэтому полифенолами называются сложные органические вещества, в состав молекул которых входит несколько бензольных колец.
Профессор М. Н. Запрометов, занимающийся изучением полифенолов свыше четверти века, указывает, что их число в настоящее время достигло двух тысяч.
Среди этого огромного количества полифенольных соединений выделяются флавоноиды - наиболее сложные по химическому строению вещества. Каждая молекула флавоноидов представляет собой два циклических бензольных кольца, соединенных 3-углеродной цепочкой. Обозначаются они буквами А и Б. Большинство флавоноидов имеет структуру молекул, получившую название флавана (рис. 1).
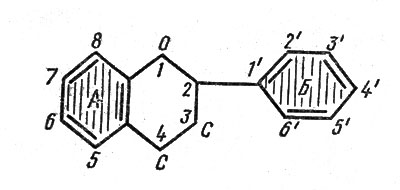
Рис. 1. Общая схема строения молекулы флавоноидов: А, Б - основное и боковые бензольные кольца
Термин "флавоноиды" по отношению к веществам с таким строением молекул был впервые введен в обиход английскими учеными Т. Гейссманом и Е. Гинрейнером еще в 1952 году.
Флавоноиды образуются всеми растительными организмами: в большей мере - цветковыми растениями, в меньшей - мхами, хвощами, папоротниками. В растительных клетках, этих мельчайших структурных единицах всех живых организмов, флавоноиды могут находиться как в свободном, так и в связанном состоянии. Связаны они чаще всего с сахарами (глюкоза, рамноза, ксилоза, арабиноза и др.) и называются гликозидами (от греческого "гликис" - сладкий) (рис. 2). Свободные флавоноиды называются агликонами, т. е. лишенными сахара (от греческих "а" - частица отрицания и "гликис"). Если с агликоном связан сахар глюкоза, то такой гликозид называется глюкозидом.
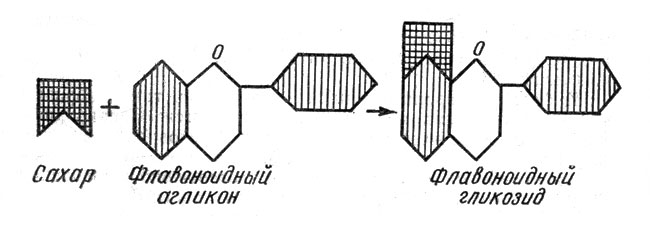
Рис. 2. Схема образования гликозидов путем присоединения сахара к молекуле флавоноидного агликона
С сахарами агликоны связываются или через атом кислорода (О-гликозиды), или же через атом углерода (С-гликозиды). Однако наличием только названных гликозидов не исчерпывается все богатство и разнообразие флавоноидов. Оно обусловливается еще и присутствием других веществ, присоединенных к агликону, и типом химической связи, и местом присоединения. Основная группа связанных флавоноидов - это О-гликозиды. В зависимости от количества входящих в их молекулы сахаров и порядка их присоединения эта группа подразделяется в свою очередь еще на несколько подгрупп.
Как правило, местом накопления связанных флавоноидов являются те растительные ткани и органы, которые отличаются наиболее высоким уровнем обмена веществ. С чем это связано? Дело в том, что взаимодействие агликонов с сахарами имеет важное значение в жизни растительного организма. Ведь гликозиды очень хорошо растворимы в воде и клеточном соке, обильно заполняющих вакуоли взрослых клеток. Благодаря этому они обладают более высокой подвижностью по сравнению с агликонами, активнее их вступают в различные биохимические процессы. В ряде случаев они "охотно" отдают свой сахар на различные нужды клетки. Словом, гликозиды нужнее всего там, где оживленнее протекают важнейшие жизненные процессы растительного организма.
Свободные флавоноиды (агликоны) чаще всего обнаруживаются в органах и тканях накопления - семенах, сердцевине деревьев, ягодах и др. В целом все семейство флавоноидов подразделяется в свою очередь на ряд групп: катехины, антоцианы, лейкоантоцианы, флавонолы, флавононолы, флавоны, изофлавоны, флавононы, халконы, дигидрохалконы, ауроны. Различия в свойствах этих групп обусловлены во многом степенью окисленности или восстановленности трехуглеродной цепочки, связывающей кольца А и Б их молекул. Вот как выглядит, например, эта цепочка в ряду "катехины - флавонолы" (рис. 3).
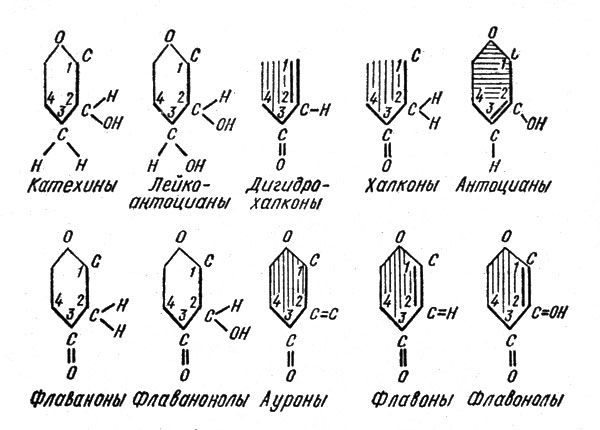
Рис. 3. Схема строения трехуглеродной цепочки, связывающей кольца А и Б, в молекулах различных групп флавоноидов
Как видим, наиболее окисленными в этом ряду являются флавонолы, наиболее восстановленными - катехины. Флавоны и флавонолы (от латинского "флавус" - желтый), а также дигидрохалконы, халконы и ауроны имеют желтую окраску, антоцианы окрашены в красный, синий, фиолетовый цвета или же в различные их оттенки. Все остальные флавоноиды бесцветны. Эти различия в окраске подчеркнуты на рис. 3 соответствующим цветом трехуглеродной цепочки.
Где же локализованы флавоноиды в пределах клетки, в какой части ее они обнаруживаются?
Обычно флавоноиды растворены в клеточном соке вакуолей, реже их можно найти в стенках клеток. Попытки обнаружить ферменты, принимающие участие в формировании молекул этих веществ в пластидах (мельчайших клеточных образованиях, рассеянных в цитоплазме), не удавались. Однако недавно в хлоропластах (клеточных пластидах, где совершается процесс фотосинтеза) найдены многие флавоноидные агликоны и некоторые ферменты, в связи с чем хлоропласт считается сейчас первичным местом образования простейших флавоноидов. В последнее время установлено присутствие в хлоропластах разнообразных флавоноидных гликозидов и эфиров. На примере люпина, льна и гороха А. П. Волынец и Р. А. Прохорчик (1974, 1978) показали, что в хлоропластах обнаруживаются все те флавоноиды, что и в целых листьях, причем по составу агликонов они часто превосходят своих листовых "собратьев".
Как же образуются флавоноиды в растительных клетках и тканях?
Вопрос этот издавна занимал умы ученых-биологов и долгое время они искали вещество - основной предшественник, из которого формируются кольца А и Б сложной молекулы флавоноидов. Эту проблему тридцать лет тому назад решила группа американских биохимиков во главе с Б. Девисом. Они выяснили, что предшественником одного из колец молекулы флавоноидов - кольца Б - является шикимовая кислота, выделенная впервые немецким ученым Й. Эйкманом из плодов аниса еще в 1885 году. Одновременно австралийские химики А. Барч, Р. Месси-Уэстропп и К. Мойс подтвердили предположение французского ученого Ж. Колли о том, что циклические соединения могут образовываться из уксусной кислоты. Они доказали на примере грибка пеницилла, что уксусная кислота является предшественником кольца А в молекуле флавоноидов. Так были установлены принципиальные пути образования флавоноидов, которые в дальнейшем получили название соответственно шикиматного (от шикимовой кислоты) и ацетатно-малонатного (от уксусной и малоновой кислот). Выяснению детального механизма образования флавоноидов в растениях способствовали исследования М. Н. Запрометова (СССР) и Г. Гризебаха (ФРГ).
Биосинтезу флавоноидов (рис. 4) в растениях как бы противостоит образование белка - основного носителя жизни. Выходит, флавоноиды - извечные соперники белка в ущерб жизненным функциям клеток?
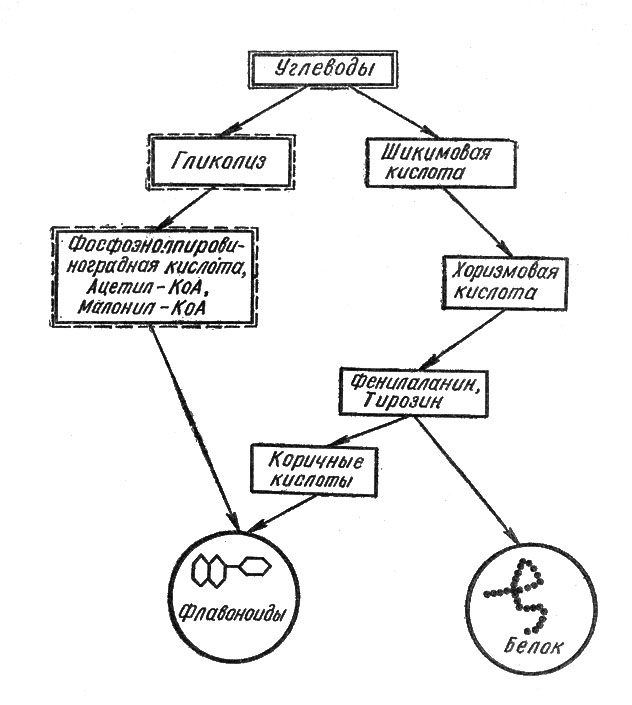
Рис. 4. Схема образования флавоноидов в растениях (по М. Н. Запрометову с некоторыми видоизменениями). Слева - ацетатно-малонатный, справа - шикиматный путь формирования молекул флавоноидов
Действительно, как выяснилось, эти вещества соперничают с белком за использование аминокислоты фенилаланина (в ряде случаев - также и тирозина) для построения своих молекул. Однако соперничество это протекает не в ущерб жизненным процессам растительных организмов, а представляет собой пример реализации одного из альтернативных (запасных) путей в осуществлении нормальных функций клетки. Немецкий ученый М. Ленк в 1967 г. обратил внимание на тот факт, что аминокислоты фенилаланин и тирозин могут направлять течение внутренних процессов в клетках то в сторону образования белка, то - фенольных соединений. В настоящее время этот аспект образования флавоноидов и их биологического значения успешно изучается группой советских ученых во главе с профессором У. В. Маргна (Эстонская ССР). По их мнению, между белками и флавоноидами существует обратная взаимосвязь: если усиленно формируются молекулы белковых веществ, то ослабляется биосинтез флавоноидов и наоборот. Например, в условиях обильного азотного питания растений естественная антоциановая окраска их заметно ослабевает - растения переключают использование азотистых веществ на формирование белковых молекул.
Изучая накопление флавоноидов в зеленой массе кормовых растений на заливных лугах в пойме рек Сож (в окрестности г. Гомеля) и Ипуть (Гомельская и Брянская обл.), мы обратили внимание на следующее обстоятельство. Большинство кормовых злаков, содержащих обычно меньше белка по сравнению с бобовыми растениями, накапливает в зеленой массе 75-316 мг флавоноидов на каждые 100 г сухого вещества, в то время как бобовые (клевер, мышиный горошек), cклонные к накоплению белка, содержат только 29-36 мг флавоноидов в 100 г воздушно-сухой массы.
И еще об одном аспекте биологического значения флавоноидов. Накапливаются они в растительных тканях нередко в значительных количествах. У. В. Маргна отмечает, что для выполнения многих хорошо известных на сегодняшний день функций (регуляция ростовых процессов, развитие иммунитета, участие в биологическом окислении веществ и др.) "...необходимо, как правило, наличие только каталитических (т. е. незначительных. - И. К.) количеств флавоноидов в клетках, что в сотни и тысячи раз меньше обычного содержания флавоноидных производных в органах растений". Естествен вопрос: какой же смысл в накоплении огромного количества флавоноидов в растительных клетках?
Окончательного ответа на него пока еще нет, но ключом к его решению во многом служит деятельность фермента, который называется фенилаланин-аммиаклиаза (ФАЛ). Еще в 60-х годах нашего века канадские биохимики Г. Тауэре, М. Юнг и А. Нейш обратили внимание на широчайшее распространение этого фермента в растительных клетках. Исследования последнего времени показали, что возрастание активности ФАЛ часто сопровождается повышением содержания флавоноидов. На свету этот процесс протекает активнее, чем в темноте.
Какова же связь между деятельностью ФАЛ и накоплением флавоноидов? Этот фермент ускоряет отщепление аминогруппы NH2 от молекул аминокислоты фенилаланина, т. е. осуществляет распад, разрушение (так называемое "прямое дезаминирование") молекул этой незаменимой для организмов аминокислоты*. В результате такой "работы" фермента образуется вещество с совершенно новыми свойствами - коричная кислота (рис. 5).
* (Аналогичное действие с аминокислотой тирозином производит другой фермент - тирозин-аммиаклиаза (ТАЛ). )
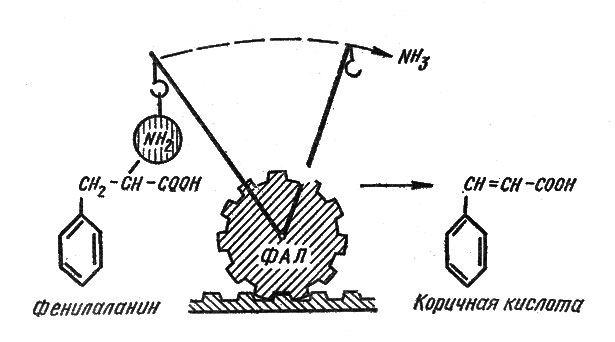
Рис. 5. Схема превращения аминокислоты фенилаланина в коричную кислоту под действием фермента фенилаланин-аммиаклиазы (ФАЛ)
Образовавшаяся коричная кислота не является фенольным соединением, так как не содержит обязательной для всех фенолов группы ОН в циклической части молекулы. Но это вещество дает начало в растительных клетках целому ряду фенольных соединений, получивших название оксикоричных кислот (от группы ОН, называемой иначе оксигруппой): паракумаровой (оксикоричной), кофейной, феруловой, синаповой. В свободном виде коричные кислоты более активны, поэтому нетрудно представить себе, что накопление их в клетках было бы в какой-то мере опасным для растительного организма. Эти кислоты являются непосредственными предшественниками флавоноидов.
Профессор У. В. Маргна (1972) считает, что включение коричных кислот в состав молекул флавоноидов - это не только способ их нейтрализации, но и общебиологический механизм, обеспечивающий возвращение продуктов распада белковых веществ (а фенилаланин является необходимой составной частью белковых молекул) в общий круговорот веществ растительного организма. Биологический смысл накопления флавоноидов в растительных клетках, по мнению И. В. Маргна, состоит в "умении" растений экономно распоряжаться углеродом своих органических соединений. Ключевое место в этом деле принадлежит незаменимой аминокислоте фенилаланину, "запасы" которой в клетках всегда меньше двух основных ее "потребителей" - биосинтеза флавоноидов и биосинтеза белка.
На первом месте у растений, конечно же, стоит проблема белка, поскольку он является носителем жизни. Но вот наступает момент, когда все нуждающиеся клетки обеспечены белком, а исходный "материал" - фенилаланин - израсходован не полностью. В процессе длительного развития растительные клетки выработали в себе способность "терпеливого ожидания" этого момента. Соответствующие ферменты, под контролем и при участии которых осуществляется формирование молекул флавоноидов, сохраняют обычно повышенную стойкость по сравнению с ферментами белкового синтеза. Они практически в любой момент находятся в "состоянии готовности" использовать фенилаланин, оказавшийся излишним для белковых нужд. Заметим, что такое "вынужденное" использование фенилаланина для образования флавоноидов отмечено при внедрении в растительный организм инфекции, при обработке растений гербицидами и в некоторых других случаях. Словом, путь формирования флавоноидных молекул в клетках всегда "оказывается кстати", стоит только растению попасть в нестандартную жизненную ситуацию.
Некоторые ученые (А. Нейш в Канаде, Г. Гризебах в ФРГ и др.) отмечают, что фенилаланин занимает ключевую позицию в биосинтезе не только флавоноидов, но и ряда других близкородственных полифенолов. М. Я. Оттер и У. В. Маргна (1975) обнаружили, например, синхронность накопления в проростках гречихи под влиянием фенилаланина как флавоноидов, так и хлорогеновой кислоты - фенольного вещества, выполняющего (в комплексе с некоторыми другими соединениями, например, фитоалексинами) роль защитного механизма в клетках от возбудителей заболеваний.
Другими словами, формирование молекул флавоноидов, хлорогеновой кислоты и других полифенолов рассматривается как наличие и проявление различных возможных путей в одном и том же процессе - быстром использовании свободных оксикоричных кислот, образующихся при распаде молекул фенилаланина под действием фермента ФАЛ. Характерно, что этот фермент "заявляет" о своем существовании на самых ранних этапах развития растительных организмов. Так, по наблюдениям М. Н. Запрометова и С. В. Шипиловой (1972), при проращивании семян кукурузы ФАЛ "дает о себе знать" уже на второй день появления проростков. Ее активность нарастает до 4-5-го дня, одновременно накапливаются флавоноиды, а также другие фенольные соединения. Скорость накопления и состав их значительно выше на свету, чем в темноте.
Следует заметить, что роль фермента ФАЛ, по-видимому, гораздо шире, чем только регуляция взаимоотношений между образованием флавоноидов и белковых веществ. В некоторых случаях, например, на обнаруживается повышенная активность этого фермента в местах значительного накопления фенольных соединений, или же наоборот - при высокой активности ФАЛ не всегда удается найти достаточно много фенолов. Так, в одной из своих работ С. В. Шипилова и М. Н. Запрометов (1977) отмечают, что в корнях молодых проростков чайного растения при достаточно высокой активности этого фермента катехины (наиболее характерные флавоноиды чая) или вообще отсутствуют, или же содержатся в незначительном количестве.
Где же используются в таком случае продукты распада аминокислоты фенилаланина, которую как бы "опекает" фермент ФАЛ? Они расходуются на формирование молекул лигнина - вещества, пропитывающего стенки растущих клеток, а также на образование других жизненно важных соединений.
Много общих свойств имеют флавоноиды растительных клеток. Но наиболее важным достоинством многих из них является способность проявлять биологически активное действие на организм человека, сходное с действием витамина Р. Заключается оно в предохранении кровеносных капилляров от ломкости и предотвращении подкожных кровоизлияний. За это свойство соответствующие флавоноиды получили название Р-активных веществ, т. е. веществ, проявляющих Р-витаминное действие. Л. И. Вигоров (1969, 1976) указывал, что необходимо различать профилактическую и лечебную потребность организма человека в Р-активных веществах. Для предупреждения хрупкости и проницаемости кровеносных капилляров следует, по мнению автора, принимать не менее чем 100-200 мг Р-активных флавоноидов в сутки. Если же из-за длительного недостатка этих веществ в организме произошли серьезные нарушения кровеносных сосудов, то дозу полифенолов следует увеличить до 1-2 г.
Где же их взять?
Главным источником Р-активных флавоноидов для человека являются фрукты и ягоды. В книге "Сад лечебных культур" (1976), увидевшей свет уже после кончины автора, Леонид Иванович Вигоров, заглядывая вперед с позиций сегодняшнего дня, писал: "И садовод далекого будущего с удивлением вспомнит о тех непонятных для него временах, когда о ценности плодов и ягод судили лишь по их вкусу, размеру и аромату, не считаясь с их действительным значением для охраны здоровья и увеличения длительности жизни человека".
В настоящее время установлено Р-витаминное действие на организм человека и животных антоцианов, лейкоантоцианов, катехинов, флавонов и флавонолов. Каждая из этих групп биологически активных флавоноидов (биофлавоноидов) имеет свои особенности. Об этих группах флавоноидов наш дальнейший рассказ.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'