
Фотосинтез
Способность фототрофных бактерий к фотосинтезу, как и у растений, определяется наличием магнийсодержащих порфириновых пигментов - хлорофиллов. Состав бактериальных хлорофиллов, называемых бактериохлорофиллами, отличается от хлорофиллов растений (рис. 129). Наиболее распространен бактерио-хлорофилл a1, этерифицированный, как и хлорофилл а растений, фитолом. Но он отличается от этого пигмента тем, что во втором положении первого пиррольного кольца содержит ацетильную группу вместо винильной, а второе пиррольное кольцо его восстановлено. Кроме этого пигмента, у R. rubrum обнаружен бактериохлорофилл ag, этерифицированный транс, трансгеранилгераниолом (С20Н33ОН). У двух пурпурных бактерий (Thiocapsa pfennigii и Rhodopseudomonas viridis) найден так называемый бактериохлорофилл b. Формула его еще не установлена, но по спектральным свойствам он отличается от всех других хлорофиллов. Зеленые бактерии в небольшом количестве содержат бактериохлорофилл а. Но основными их пигментами являются бактериохлорофиллы с и d, содержащие вместо фитола (С20Н39ОН) транс, трансфарнезол (С15Н25ОН). Каждый из этих хлорофиллов состоит из компонентов, различающихся радикалами в положениях 4, 5 и d.
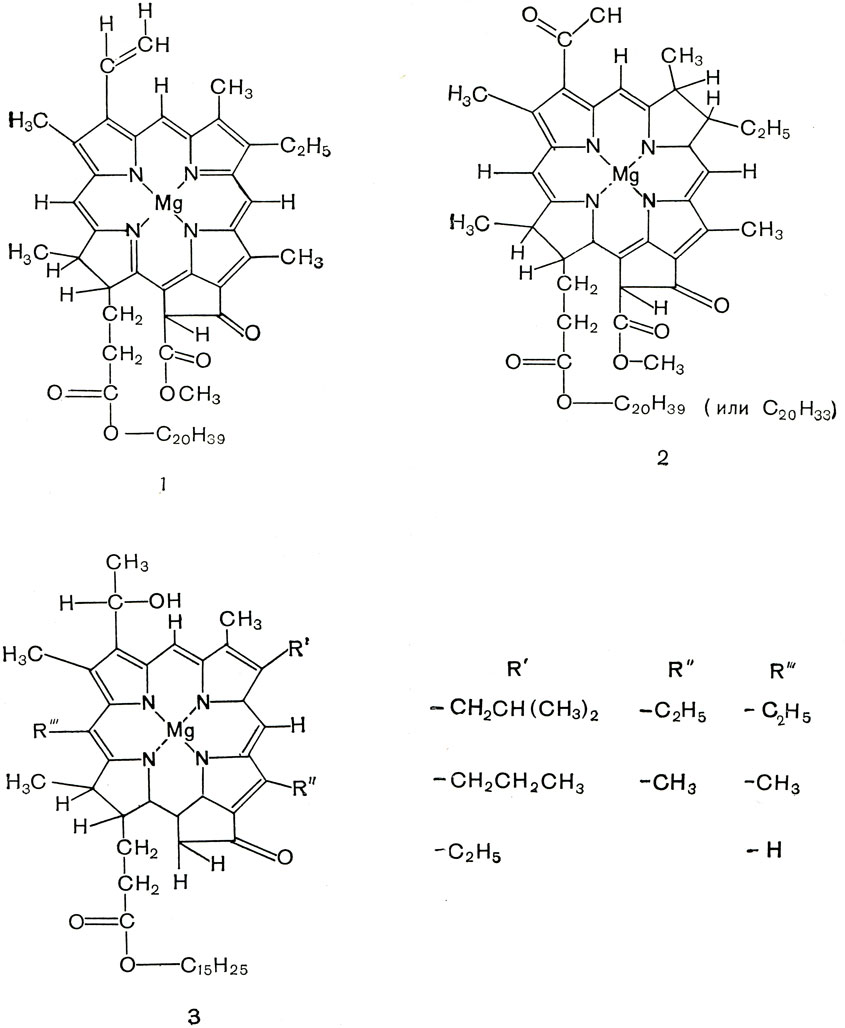
Рис. 129. Структурные формулы хлорофилла a и бактериохлорофиллов: 1 - хлорофилл растений; 2, 3 - бактериохлорофиллы
По сравнению с хлорофиллами растений бактериохлорофиллы, особенно в клетках, поглощают свет в более длинноволновой области. Зеленые бактерии абсорбируют свет примерно до 850 нм, пурпурные бактерии, содержащие бактериохлорофиллы а, - до 900 нм, а пурпурные бактерии, синтезирующие бактериохлорофилл b - до 1100 нм. При этом в инфракрасной области бактериохлорофиллы in vivo обусловливают, как правило, не один, а несколько максимумов поглощения (рис. 130).
Наличие максимумов поглощения бактериохлорофиллов в области 800 - 1100 им обеспечивает возможность роста фототрофных бактерий, особенно пурпурных, при наличии только невидимых инфракрасных лучей. Этим пользуются для получения накопительных культур данных микроорганизмов и разделения видов, содержащих бактериохлорофиллы а и b.
Различия в спектрах поглощения отдельных представителей фототрофных бактерий, а также фототрофных бактерий и растений имеют экологическое значение, позволяя развиваться им в одних и тех же местах.
Кроме хлорофиллов, все фототрофные бактерии содержат каротиноиды, состав которых у разных видов неодинаков и достаточно разнообразен. Всего к настоящему времени у фототрофных бактерий обнаружено около шестидесяти каротиноидов, причем некоторые из них у других организмов не встречаются. Для большинства пурпурных бактерий характерно наличие алифатических каротиноидов, содержащих часто гидроксильные, метоксильные или кетогруппы. Это - ликопин, спириллоксантин, родивибрин, родопин, сфероиден, сфероиденон и другие близкие пигменты. Некоторые пурпурные бактерии синтезируют каротиноиды, имеющие одну арильную группу (ароматическое кольцо). К их числу принадлежит окенон. Но лишь у R. vannielii и Rh. acidophila найден β-каротин, распространенный у сине-зеленых водорослей и других фотосинтезирующих и нефотосинтезирующих организмов. У Rh. acidophila значительная часть родопина и родопинала связана с глюкозой и находится в форме гликозидов.
У большинства зеленых серобактерий основным каротиноидом является моноциклическое соединение с ароматическим кольцом, названное хлоробактином. Но некоторые представители этих микроорганизмов синтезируют изорениератин, имеющий два ароматических кольца (рис. 131). Кроме того, у зеленых серобактерий в небольшом количестве находят γ-каротин ликопин и родопин.
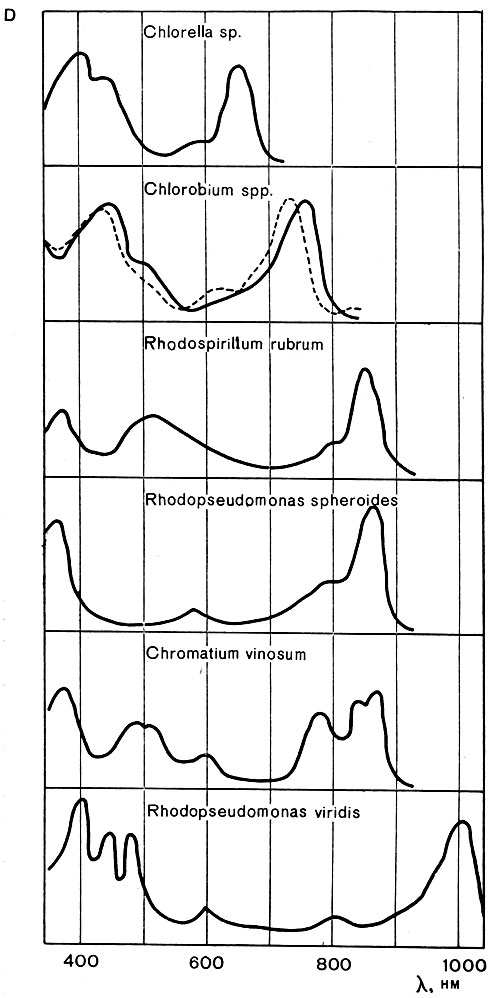
Рис. 130. Спектры поглощения клеток водорослей (Chlorella), зеленых и пурпурных бактерий
Интересен состав каротиноидов у недавно выделенных скользящих микроорганизмов рода Chloroflexis, которые, подобно многим зеленым бактериям, содержат бактериохлорофиллы а и с. У Chloroflexis sp. штамм F-2 установлено 9 таких пигментов. В наибольшем количестве содержатся β-каротин, γ-карантин и перацетил-О-гликозил-1'-окси-1', 2'-дигидро-3', 4'-дигидро-γ-каротин. В числе других каротиноидов выделен эхиненон, присутствующий у сине-зеленых водорослей.
Рис. 131. Структурные формулы некоторых каротиноидов фототрофных бактерий
Состав и содержание отдельных каротиноидов определяют в основном цвет культур пурпурных бактерий, который бывает розовым, красным, фиолетовым, желтым или почти коричневым. В какой-то степени от состава каротиноидов зависит окраска зеленых бактерий. Она может быть не только зеленой, но желтоватой или коричневой. Показано, что каротиноиды у фототрофных бактерий могут выполнять следующие функции: 1) участвовать в фотосинтезе, поглощая свет в пределах 400 - 550 нм и передавая энергию возбужденных состояний молекулам бактериохлорофилла; 2) вызывать фототаксис; 3) защищать клетки от фотосенсибилизированного окисления кислородом. Не исключено, однако, что функции этих пигментов до конца не выяснены. Как и хлорофиллы, каротиноиды фототрофных бактерий локализуются в их фотосинтезирующем аппарате - хроматофорах. Кроме того, эти образования содержат ряд соединений, способных выполнять функцию переносчиков электронов (водорода) и характеризующихся разными окислительно-восстановительными потенциалами. К ним относятся в первую очередь цитохромы, а также хиноны, флавины, никотинамид - дениннуклеотиды и некоторые другие компоненты клеток.
Фотосинтез начинается с поглощения квантов света молекулами хлорофилла и другими связанными с ним пигментами. Молекула пигмента, получившая квант света, переходит в возбужденное состояние, которое длится очень недолго (≤-9сек) и заканчивается возвращением ее к исходному, стабильному уровню. Этот переход сопровождается либо передачей возбужденного состояния другой молекуле пигмента, либо потерей сообщенной энергии в виде тепла, флуоресценции и фосфоресценции. При миграции энергии электронных возбужденных состояний по пигментному комплексу она может частично достичь так называемых реакционных фотохимических центров. В такие центры входят молекулы хлорофилла и связанные с ними переносчики электронов. Их принято обозначать буквой П с указанием той длины волны, где они сами обусловливают поглощение света. У пурпурных бактерий пигменты, входящие в фотохимические центры, обозначают как П970, или П890, или П895, а у зеленых бактерий - П840. Таким образом, большинство молекул хлорофилла только "абсорбируют" лучистую энергию, а за ее использование для фотосинтеза ответственна лишь небольшая их часть. Расчеты показывают, что на одну молекулу бактериохлорофилла, входящего в реакционный центр, приходится 25 - 50 других молекул этого пигмента. Для растений это соотношение еще меньше (1 : 250 - 400).
Возбужденная молекула пигмента фотоактивного центра (П*) может отдавать электрон связанному с ней первичному акцептору (А) и окисляться. Но в результате немедленного взаимодействия с донором электрона (В) она возвращается в исходное состояние (П):
П + hy → П*
П* + А → П ++ А-
П+ В→ П + В+
Природа первичного акцептора электрона ни у бактерий, ни у растений точно до сих пор не установлена. Что касается донора электрона, взаимодействующего с П, то, по всем данным, у бактерий - это цитохром типа с.
Фотохимическая стадия фотосинтеза обеспечивает поднятие электрона на высокий энергетический уровень и начало транспорта его через ряд переносчиков с постепенно снижающимися окислительно-восстановительными потенциалами. Перенос электрона может происходить по циклическому и нециклическому пути. В первом случае он возвращается к исходному донору, т. е. к пигменту фотоактивного центра; при втором этого не происходит. Поэтому для поддержания нециклического транспорта электронов необходим экзогенный Н-донор, который восполняет их потерю.
Обе такие системы функционируют при фотосинтезе у растений (рис. 132). Перенос электрона по циклическому пути, как и в дыхательной цепочке, сопряжен с синтезом АТФ. Механизм этих процессов, видимо, одинаков. В результате транспорта электронов по нециклическому пути, кроме АТФ, происходит образование восстановителей, используемых при ассимиляции углекислоты и других соединений. Эту функцию выполняют восстановленный ферредоксин и никотинамидадениндинуклеотиды (НАДН и НАДФН). АТФ и указанные восстановители рассматриваются как первые стабильные продукты фотосинтеза, которые иногда называют "ассимиляционной силой".
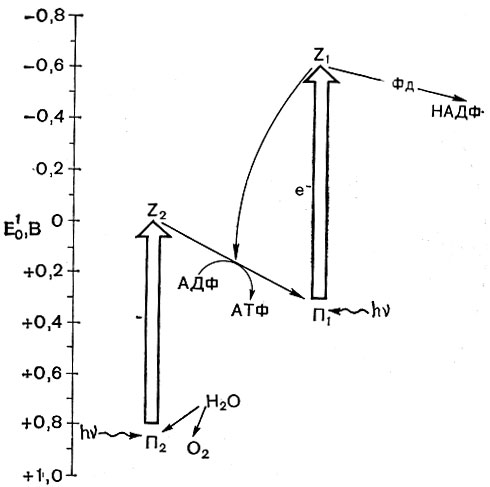
Рис. 132. Схема переноса электронов при фотосинтезе у растений: П1 и П2 - пигменты фотоактивных центров; Z1 и Z2 - первичные акцепторы электрона; Фд - ферредоксин; НАДФ - никотинамидадениндинуклеотидфосфат; АТФ - аденозинтрифосфат
При бактериальном фотосинтезе также имеет место циклический путь переноса электронов, сопряженный с образованием АТФ. Но способ образования восстановителей не вполне ясен. Не исключено, что их образование, как и у растений, происходит в результате функционирования нециклической фотосинтетической системы транспорта электронов. Однако ряд данных свидетельствует о том, что бактерии могут восстанавливать НАД в результате так называемого обратного или обращенного переноса электрона без непосредственного участия пигмента фотохимического центра (рис. 133). Энергия, необходимая для такого переноса электрона против термодинамического градиента, может обеспечиваться затратой части АТФ или непосредственно за счет энергии трансмембранного потенциала, образование которого сопряжено с циклическим транспортом электрона (рис. 133). Возможно, реализуются оба пути.
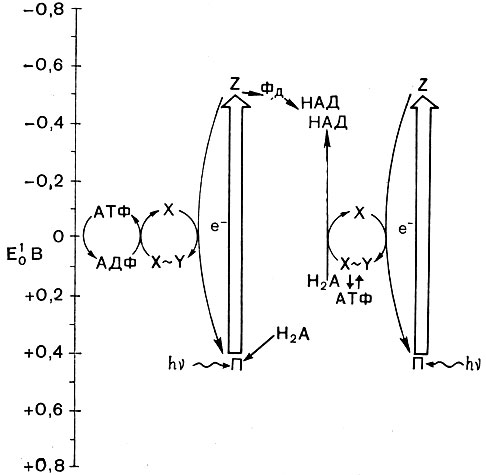
Рис. 133. Возможные пути переноса электронов при фотосинтезе у бактерий. П - пигмент фотоактивного центра; Z - первичный акцептор электрона; Фд - ферредоксин; НАД - никотинамидадениндинуклеотид; X ˜ У - макроэргическое соединение, предшествующее АТФ, АТФ - аденозинтрифосфат
Каковы бы ни были способы образования восстановителей при бактериальном фотосинтезе, очевидно, что для этого, как и у растений, требуется экзогенный Н-донор.
В результате изучения фотосинтеза у бактерий и сравнения его с фотосинтезом у растений Ванниль показал, что итог этих процессов может быть выражен одним общим уравнением
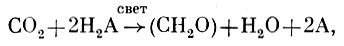
где H2А - донор (СH2О) - символ веществ.
Природа H2A может быть разной. У растений такую функцию выполняет вода. Поэтому фотосинтез сопровождается выделением кислорода:
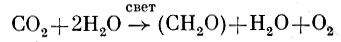
У бактерий Н-донором служат сероводород, сера, тиосульфат, молекулярный водород или органические соединения. Поэтому кислород не выделяется, а накапливаются продукты их окисления:
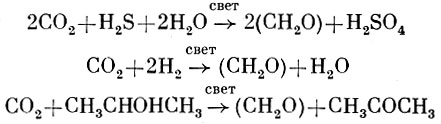
Такое различие в природе Н-донора отражается на начальных стадиях фотосинтеза. Поскольку бактерии используют в качестве Н-донора достаточно восстановленные соединения, то для использования их электронов на восстановление НАД хватает поглощения одного кванта света. При использовании в качестве Н-донора воды требуется затратить больше энергии, чтобы поднять ее электрон до уровня ферредоксина и НАДФ. Поэтому при фотосинтезе у растений имеют место по крайней мере две фотохимические реакции, которые осуществляются последовательно в разных пигментных системах, различающихся по поглощению света. При бактериальном фотосинтезе, видимо, имеет место только одна фотохимическая реакция и действует одна пигментная система. В результате также происходит преобразование энергии света в энергию химических связей.
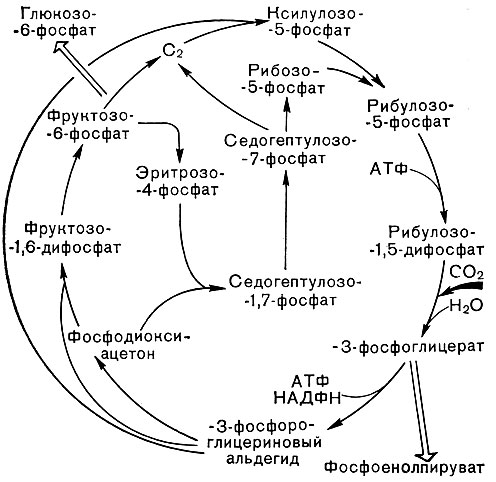
Рис. 134. Пентозофосфатный восстановительный цикл углерода (цикл Кальвина)
Поскольку фотосинтез начали изучать у высших растений, сложилось мнение, что он заключается в синтезе из углекислоты преимущественно углеводов. Сейчас стало очевидным, что первичные стабильные продукты фотосинтеза используются для усвоения и других соединений и могут образовываться разные продукты. Однако это не противоречит тому, что по своим масштабам фотоассимиляция углекислоты превосходит все другие процессы, идущие за счет использования лучистой энергии. Ассимилировать углекислоту способны все фототрофные организмы, но не для всех она может служить единственным источником углерода. Примером, как указывалось выше, служат некоторые пурпурные бактерии.
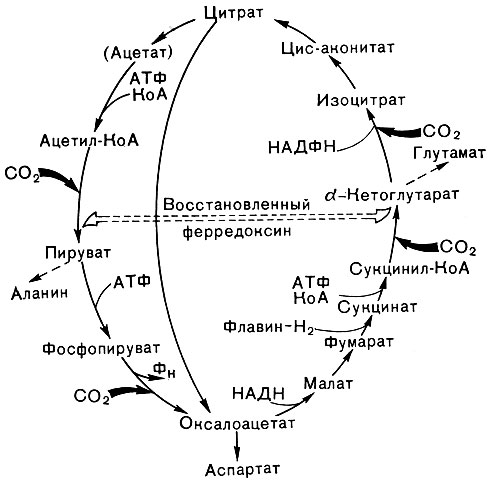
Рис. 135. Восстановительный цикл карбоновых кислот (цикл Арнона)
Основной путь усвоения углекислоты растениями связан с функционированием пентозофосфатного восстановительного цикла углерода, известного под названием цикла Кальвина (рис. 134). При этом углекислота фиксируется на рибулозодифосфате с образованием 3-фосфоглицериновой кислоты, а затем фосфорных эфиров Сахаров. Кроме такого механизма, у некоторых растений, происходящих из тропических областей (сахарного тростника, кукурузы и ряда других), установлено наличие особого цикла, названного циклом С4-дикарбоновых кислот или β-карбоксилирования. В данном случае углекислота фиксируется на фосфоенолпирувате с образованием оксалоацетата и далее малата и аспартата. Малат затем, видимо, декарбоксилируется и передает углекислоту в цикле Кальвина. Таким образом, цикл С4-дикарбоновых кислот имеет вспомогательное значение, обеспечивая более эффективный фотосинтез, особенно в условиях невысокого содержания углекислоты.
Цикл Кальвина функционирует и у различных представителей пурпурных бактерий, как серных, так и несерных. Есть данные, что специфические ферменты цикла Кальвина содержат и некоторые зеленые бактерии, однако не все. У некоторых штаммов С. limicola не удалось обнаружить рибулозодифосфаткарбоксилазу - ключевой фермент этого цикла, катализирующего фиксацию СО2 на рибулозо-1,5-фосфате.
В то же время есть данные, что у зеленых бактерий, а также у некоторых пурпурных бактерий (R. rubrum) может функционировать особый путь ассимиляции углекислоты, названный восстановительным циклом карбоновых кислот или циклом Арнона (рис. 135). В этом цикле углекислота фиксируется на органических кислотах, причем две реакции, а именно карбоксилирование ацетил-КоА и сукцинил-КоА, происходят при участии восстановленного ферредоксина. В последнее время, однако, появились сомнения относительно возможности функционирования полного цикла Арнона, поскольку у некоторых зеленых и пурпурных бактерий не удалось показать превращения цитрата в оксалоацетат и ацетил-КоА, без чего данный механизм функционировать не может. Но, несомненно, реакции карбоксилирования, входящие в этот цикл, имеют место. Фототрофные бактерии проявляют способность и к другим реакциям карбоксилирования, общее число которых, видимо, больше, чем у растений. Многие представители этих микроорганизмов, например, способны карбоксилировать пируват и фосфоенолпируват, образуя оксалоацетат или малат. У нескольких видов показана возможность карбоксилирования пропионил-КоА с образованием либо метилмалонил-КоА и далее сукцината, либо α-кетобутирата.
У всех известных представителей фототрофных бактерий проявляется способность к фотоассимиляции органических соединений: ацетата, пирувата, а иногда также пропионата, сукцината, малата и др. При этом потребность бактерий в углекислоте часто заметно снижается, хотя урожай клеток увеличивается. В зависимости от характера органического соединения, особенностей организма и условий, в которых он находится, пути ассимиляции органических субстратов, как и углекислоты, могут быть различными.
Нередко ассимиляция органических соединений связана с реакциями карбоксилирования, например происходит карбоксилирование ацетил-КоА или пирувата. Может также происходить усвоение органических соединений в результате включения их в цикл трикарбоновых кислот и действия глиоксилатного шунта (рис. 136), которые функционируют у некоторых пурпурных бактерий.
В условиях интенсивного роста фототрофных бактерий большая часть первичных продуктов ассимиляции углекислоты и органических соединений используется на синтез белков и других важнейших компонентов клеток. Но при задержке роста культур в результате недостатка фосфора и особенно азота происходит образование в больших количествах запасных веществ. И пурпурные и зеленые бактерии могут накапливать в качестве запасных продуктов полисахариды типа гликогена. Пурпурные бактерии образуют, кроме того, поли-α-оксимасляную кислоту (С4Н602)n. Накопление того или другого запасного соединения зависит не только от особенностей организма, но и от источника углерода. Полисахариды преимущественно накапливаются пурпурными бактериями при культивировании их на минеральных средах, а также в присутствии пирувата, пропионата, малата или сукцината. При использовании бутирата или ацетата, особенно в отсутствие бикарбоната, происходит накопление почти исключительно поли-α-оксибутирата, так как синтез его начинается с конденсации двух молекул ацетил-КоА с образованием ацетоацетил-КоА и далее α-оксибутирата.
Возможно также разложение фототрофными бактериями некоторых органических субстратов с выделением молекулярного водорода.
Во многих случаях этот процесс зависит от наличия света. Фотовыделение молекулярного водорода имеет также место при окислении нерастущими суспензиями клеток тиосульфата. Полагают, что таким путем происходит удаление избытка восстановителя, если он не используется в конструктивных процессах.
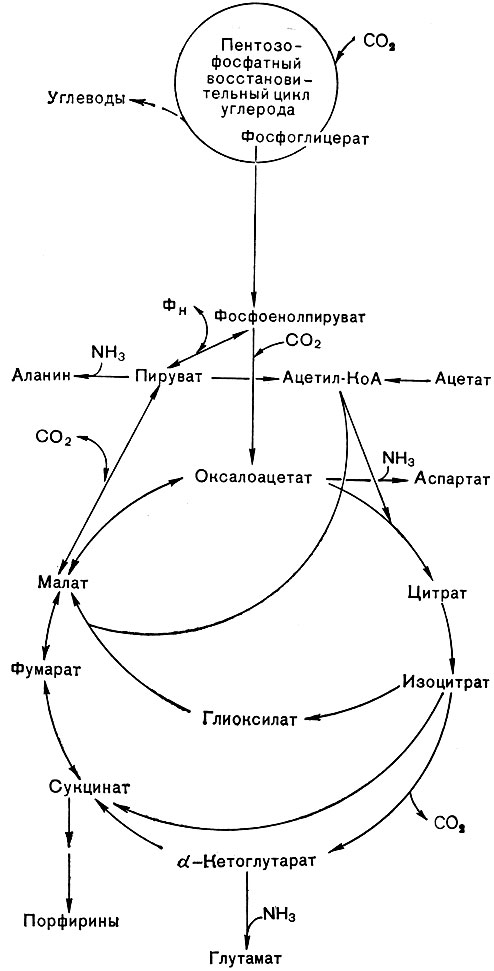
Рис. 136. Пути ассимиляции углекислоты и других соединений углерода у Rhodopseudomonas palustris
Первичные стабильные продукты фотосинтеза используются бактериями при фиксации молекулярного азота. Кроме того, они обеспечивают восстановление фототрофами сульфатов и нитратов, если таковые ассимилируются. Вообще у бактерий, когда они растут при освещении в анаэробных условиях, основным или даже единственным источником энергии служит свет.
Полагают, что первым фототрофам предшествовали какие-то анаэробные организмы, осуществлявшие брожение. Способность к этому выявлена у некоторых пурпурных бактерий. Далее, видимо, возникла способность использовать энергию света для ассимиляции готовых органических соединений, как это наблюдается у многих пурпурных бактерий. Впоследствии наряду с использованием органических соединений фотосинтезирующие организмы, видимо, стали все в больших масштабах ассимилировать углекислоту, и в результате возникли фото-автотрофы, подобные пурпурным и зеленым серобактериям.
Важнейшим этапом эволюции явилось приобретение способности фототрофов использовать в качестве Н-донора воду. В результате фотосинтез стал сопровождаться выделением кислорода, что привело к развитию аэробных организмов, которые занимают сейчас доминирующее место среди различных форм жизни. Но в конечном счете возможность существования всех организмов обеспечивается фотосинтезом, который осуществляют высшие растения, водоросли и бактерии.
Тот факт, что сине-зеленые водоросли выделяют при фотосинтезе кислород, свидетельствует о том, что возникновение этого важного свойства имело место еще на уровне прокариотных организмов, близких по организации фото-синтезирующего аппарата к некоторым пурпурным бактериям, но содержащим, видимо, хлорофилл а, который свойственен всем фототрофам, образующим молекулярный кислород.
На примере фототрофных бактерий можно представить и определенные этапы развития такой функции, как дыхание с получением энергии, рассматривая ее как вторичное приспособление данных микроорганизмов.
Известно, что даже строго анаэробные представители фототрофных бактерий поглощают кислород, а некоторые из них в результате этого синтезируют АТФ, хотя расти без света они не могут. Факультативно-аэробные виды растут в темноте на воздухе, но на свету дыхание клеток обычно заметно подавляется и бактерии получают энергию в основном в результате поглощения света. Отсюда следует, что дыхательная и фотосинтезирующая системы данных микроорганизмов имеют какие-то общие звенья и механизмы, изменяющие способы получения ими энергии.
Такое взаимоисключающее действие света и кислорода на метаболизм бактерий связано и с тем, что в отличие от эукариотных фототрофов они не имеют обособленных органелл (хлоропластов и митохондрий), где осуществляются соответственно фотосинтез и дыхание.
Появление таковых привело к разграничению данных процессов, что имело, очевидно, весьма большое значение для дальнейшей эволюции фотосинтезирующих форм, поскольку создалась возможность разделения (и пространственно и во времени) фотосинтеза и роста организмов за счет использования образованных при фотосинтезе запасных веществ в процессе дыхания с получением энергии и в конструктивных процессах.
По мнению В. Н.Шапошникова (1960), обособление фотосинтеза и дыхания явилось основной предпосылкой для возникновения многоклеточных растительных форм с дифференцированными тканями и органами, что можно наблюдать у высших растений.
Высшие растения, являясь вершиной эволюции фототрофов, занимают главное место среди наземных растений. Однако наряду с высшими растениями существуют и более примитивные фототрофы, в частности сохранились такие древние организмы, как фотосинтезирующие бактерии, что обусловлено возможностью их роста в весьма специфических условиях.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'