
Массовое культивирование микроскопических водорослей (М. Г. Владимирова, В. Е. Семененко)
Человек издавна ищет в природе и вводит в хозяйственную сферу новые виды растений и животных. И если сейчас, с одной стороны, выведены новые формы и сорта растений и возникло понятие "культурные растения", а с другой - развита целая отрасль промышленности - техническая микробиология, использующая для получения ценных веществ деятельность бактерий и микроскопических грибов, то громадный мир микроскопических водорослей, особенно одноклеточных, до недавнего времени оставался вне сферы практической деятельности людей.
Несмотря на широкую распространенность микроскопических водорослей в природе и громадное значение их в общем балансе фотосинтетической продукции на Земле, несмотря также на то, что первый опыт по выращиванию этих организмов в искусственной среде относится к 1871 г. (А. С. Фаминцин), а получение первых бактериологически чистых культур их к 1890 г. (Бейеринк), исследователи лишь в 40-е годы нашего столетия обратились к вопросам искусственного культивирования фотоавтотрофных микроскопических водорослей в связи с различными аспектами практического их использования.
Одним из реальных методов использования микроскопических водорослей в производственной деятельности человека является их массовая культура. Начало этому положили одноклеточные зеленые водоросли, которые привлекли к себе внимание как объекты для промышленного культивирования в силу высокой степени изученности и благодаря ряду ценных биологических и физиологических свойств. После накопления большого опыта стали культивировать и другие водоросли.
ОСОБЕННОСТИ МИКРОСКОПИЧЕСКИХ ВОДОРОСЛЕЙ КАК ОБЪЕКТОВ МАССОВОГО КУЛЬТИВИРОВАНИЯ
Микроскопические водоросли давно стали объектом разносторонних исследований. Благодаря малым размерам, относительной простоте морфологической организации и способов размножения эти водоросли сравнительно легко поддерживать в лаборатории обычными микробиологическими методами в виде культур на искусственных минеральных или органических, жидких или твердых (агаризованных) питательных средах, на свету или в темноте. Твердые среды используют преимущественно для сохранения водорослей (коллекции), а изучение их физиологических и биохимических свойств проводят главным образом на жидких питательных средах.
Из микроскопических водорослей в первую очередь стали применять при массовом культивировании одноклеточные протококковые водоросли (отдел Chlorophyta), в частности хлореллу и сценедесмус. Размножение этих форм упрощено до предела. У них полностью отсутствует половое размножение и рост культуры идет за счет формирования в материнской клетке дочерних автоспор, которых может быть в норме 2, 4, 8, 16, 32 (известно образование до 64 автоспор) в зависимости от штамма и условий культивирования. После окончания деления автоспоры выходят из клетки путем разрыва оболочки; молодые клетки, интенсивно фотосинтезируя, растут до стадии созревания, и весь цикл повторяется сначала (рис. 278, 1). В определенные периоды развития по циклу клетки нуждаются в свете, а в другие развитие может проходить в темноте. Эта особенность облегчает получение синхронных культур водорослей, т. е. культур, у которых все клетки находятся на одной и той же стадии развития (рис. 278, 2, 3).
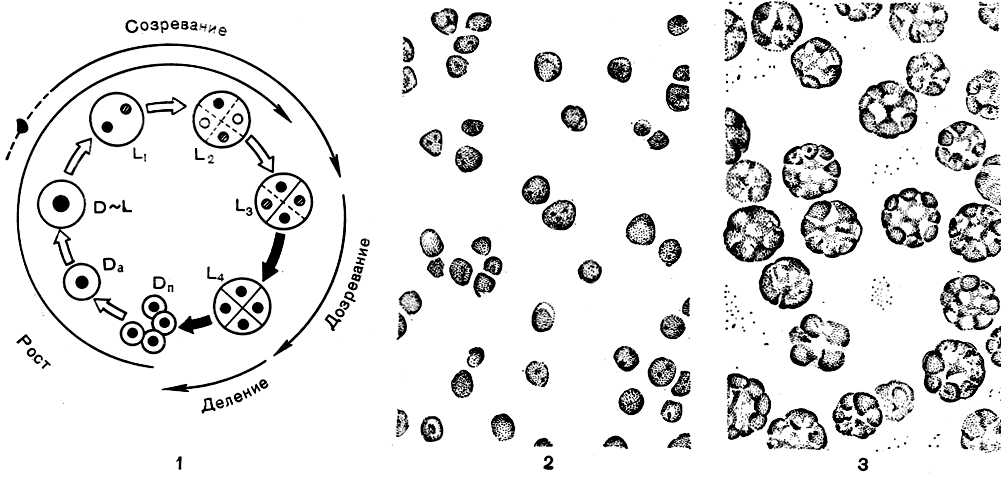
Рис. 278. Схема клеточного цикла и рост синхронной культуры хлореллы: 1 - жизненный цикл клетки, D, L - различные стадии развития клетки; 2 - молодые клетки хлореллы через 2-3 часа после выхода автоспор; 3 - делящиеся клетки со сформировавшимися автоспорами
Синхронные культуры представляют интерес для исследования онтогенеза фотосинтезирующих клеток. Такие культуры могут быть перспективны, по мнению ряда исследователей, при массовом выращивании водорослей.
Как видно из характера деления клеток, при отсутствии ограничивающих факторов рост числа клеток идет в геометрической прогрессии, в соответствии с уравнением
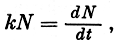
где k - удельный коэффициент размножения, N - исходное число клеток, dN - прирост числа клеток за время dt.
Однако в обычной накопительной культуре по мере увеличения числа клеток и изменения условий (истощение питательной среды, самозатенение клеток, накопление прижизненных выделений) происходит замедление темпа деления и накопления биомассы. В таких культурах рост описывается, как и у бактериальных культур, S-образной кривой и может быть разделен на несколько стадий: 1) лаг-фазу, 2) фазу логарифмического, или экспоненциального, роста, 3) фазу линейного роста, 4) плато. Длительность лаг-фазы зависит, от предыстории культуры, период экспоненциального роста у культур водорослей короткий, и чем быстрее происходит нарастание числа клеток, тем быстрее наступает самозатенение культуры, тем короче период экспоненциального роста. Линейная стадия роста культуры у водорослей наиболее длительная.
Поскольку фотосинтезирующие организмы, в отличие от гетеротрофных, нуждаются в лучистой энергии света, проникновение и распределение его в суспензии является существенным фактором обеспечения интенсивного фотосинтеза. В связи с этим немаловажным свойством культур микроскопических водорослей является гомогенность суспензии. Разница в величине дочерних и материнских клеток благодаря микроскопическим размерам не оказывает существенного влияния на светораспределение в суспензии, и с некоторым приближением суспензии микроскопических водорослей можно рассматривать как окрашенный раствор, поглощение и распределение света в котором подчиняются известному закону Бугера - Ламберта - Бера, т. е. находятся в логарифмической зависимости от концентрации клеток. Последнее облегчает расчеты световых полей внутри популяций микроводорослей, исходя из оптических свойств суспензий и особенностей световых кривых фотосинтеза клеток различных культур водорослей.
Как все зеленые растения, водоросли синтезируют из СO2 и воды в процессе фотосинтеза ценные органические вещества, такие, как белки, жиры, углеводы, витамины и другие физиологически активные соединения.
Протококковые водоросли первоначально привлекли к себе внимание благодаря высокому содержанию белка - 50-60% от сухой биомассы. В белке хлореллы имеются все незаменимые аминокислоты, по качеству его можно сравнить с белком пивных дрожжей, соевой и арахисовой муки. Его признают равноценным белку сухого молока.
В среднем в сухой биомассе хлореллы содержится 10-20% углеводов. Значительную часть их составляет крахмал, хотя у некоторых представителей, даже в пределах рода Chlorella, углеводы могут быть представлены преимущественно гемицеллюлозами. Липиды составляют 20-30% и отличаются значительным содержанием ненасыщенных жирных кислот. Соотношение жирных кислот у хлореллы сходно с соотношением, которое характерно для большинства растительных масел.
Биомасса протококковых водорослей (хлореллы, сценедесмуса) содержит богатый набор витаминов, количество которых здесь выше, чем у большинства растительных культур. Привлекает внимание также высокое содержание каротина в культурах хлореллы и сценедесмуса, однако его особенно много у дюналиеллы, относящейся к вольвоксовым.
Химический состав интенсивно размножающихся культур хлореллы достаточно стабилен. Вместе с тем обращает на себя внимание чрезвычайно высокая пластичность метаболизма хлореллы и ее способность радикально менять направленность биосинтеза в зависимости от условий культивирования и при различных воздействиях. Давно было показано для некоторых культур хлореллы, что в условиях азотного голодания в клетках может накапливаться до 85% липидов. На этом основании считали, что хлорелла имеет белково-липидную направленность метаболизма. Однако за последнее десятилетие при обследовании различных штаммов хлореллы было показано, что многие культуры обладают в тех же условиях, напротив, белково-углеводной направленностью метаболизма и могут синтезировать до 60% углеводов. У одних культур синтезируется преимущественно крахмал (до 45% от суммы углеводов), у других - гемицеллюлозы.
Таким образом, клетки хлореллы в зависимости от их генетических свойств и применяемых воздействий могут быть превращены в системы, направленно синтезирующие белки, углеводы или жиры, что открывает принципиальные возможности управления не только интенсивностью, но и качественной стороной биосинтеза у микроводорослей.
Первые попытки массового культивирования одноклеточных водорослей относятся к 40-м годам. Первоначально проводили исследования по использованию клеток культивируемых водорослей в качестве корма для молоди рыб; затем очень быстро эти водоросли стали рассматривать как возможный источник различных веществ, в том числе и пищевых.
В настоящее время одноклеточные и некоторые другие микроскопические фотоавтотрофные водоросли широко изучаются не только в СССР, но и в США, Японии, ФРГ, Франции, Италии, Швеции, Бельгии, Чехословакии, Болгарии и других странах в связи со следующими аспектами их применения: 1) сельское хозяйство - дополнительный источник белка, витаминов; 2) очистка сточных вод и биосферы; 3) проблема освоения космоса - как звено в замкнутых экологических системах, способное обеспечить биологическую регенерацию воздуха и воспроизводство пищи; 4) получение ценных метаболитов и веществ для медицинской и микробиологической промышленности, а также для получения меченых препаратов; 5) биологическая фиксация атмосферного азота; 6) использование в научно-исследовательских работах в связи с изучением фундаментальных вопросов биологического саморегулирования и биосинтеза фотосинтезирующих организмов.
Для решения этих проблем разрабатываются способы культивирования водорослей двух типов - массовая культура под открытым небом и интенсивное культивирование в замкнутых аппаратах в полностью контролируемых условиях по типу современных микробиологических производств. В обоих случаях задача заключается в получении максимальных выходов биомассы, что требует изучения путей опти-мизации роста и фотосинтетической продуктивности культур микроводорослей.
Физиологические особенности культур микроскопических водорослей как фотосинтезирующих систем
Культуры микроскопических водорослей являются целостными фотосинтезирующими системами. Для получения высокой фотосинтетической продуктивности необходимо знание физиологических особенностей этих систем, а не только физиологии отдельной клетки.
Как бы ни различались современные методы культивирования водорослей, все они основаны на снабжении клеток достаточным количеством света, углекислоты и других питательных веществ.
Исследование функциональной зависимости продуктивности культур микроводорослей от напряженности и сочетания значимых факторов - необходимая предпосылка для разработки физиологически обоснованных режимов их культивирования и принципов интенсификации их продуктивности.
Как следует из приведенного уравнения, при выращивании в условиях экспоненциального роста, но при низкой плотности суспензии можно получить высокий коэффициент размножения культуры, однако это еще не значит, что будет получен высокий суммарный урожай. Такая культура хороша для изучения потенциальных свойств клетки, но недостаточна для использования при массовом культивировании. В реальных условиях культивирования суммарная фотосинтетическая продуктивность водорослей тем выше, чем при более высокой плотности суспензии сохраняется высокая скорость размножения. И далеко не всегда результаты, полученные при исследовании разбавленных суспензий (что может быть приравнено к изучению отдельной клетки), могут быть перенесены на культуры высокой плотности. Например, впервые полученная в 1953 г. термофильная форма хлореллы (Сорокин и Майерс) прославилась еще и тем, что для нее в определенных условиях света и температуры в суспензии с низкой плотностью клеток было найдено тысячекратное увеличение числа клеток в сутки (10 удвоений). Следовательно, если создать этой культуре оптимальные условия экспоненциального роста при плотности хотя бы 50 млн. клеток в 1 мл, то 1 л такой культуры мог бы обеспечить урожай в 500 г/л в сутки и это была бы высокоинтенсивная культура водорослей, размножающаяся с максимальной скоростью и дающая высокие урожаи за максимально короткий срок. Однако организация такого рода культивирования практически трудноосуществима, так как уже при четвертом удвоении плотность культуры поднимается до 800 млн. в 1 мл и, естественно, при этом резко меняются все условия культивирования. Для правильного освещения суспензии этот литр культуры требовалось бы распределить очень тонким слоем по большой поверхности, в результате чего конструкция установки стала бы чрезвычайно сложной и громоздкой. Таким образом, для правильной организации культивирования водорослей с высокой фотосинтетической продуктивностью необходимо изучение действия хотя бы основных факторов (свет, температура, концентрация СO2 и т. д.) на фотосинтезирующие системы высокой плотности.
В отличие от популяций гетеротрофных организмов, где каждому из факторов, определяющих продуктивность культуры, обеспечен одинаковый доступ ко всем индивидам в любой рассматриваемый момент времени, в популяции автотрофных клеток исключение составляет световой фактор, который в силу оптических свойств культуры как сильно поглощающей свет среды достаточно быстро становится ограничивающим. Кратковременность экспоненциальной фазы роста в интенсивно растущих культурах и выход на линейную стадию роста объясняется быстрым формированием полностью поглощающего свет слоя, численность клеток в котором при заданной интенсивности света остается величиной постоянной, несмотря на увеличение плотности по мере роста всей популяции. Формирование такого слоя определяет достаточно резкий переход от процесса возрастания интенсивности фотосинтеза по мере роста культуры к его стационарному состоянию (и постоянству прироста числа клеток и биомассы в единицу времени), несмотря на продолжающееся суммарное увеличение числа клеток. При этом плотность культуры, при которой происходит указанный переход, различна в реакторах с разной толщиной слоя суспензии, однако поверхностная концентрация клеток в момент этого перехода остается величиной постоянной.
В плотной, вышедшей на линейную фазу роста культуре суммарная фотосинтетическая продуктивность суспензии определяется в каждый элементарный отрезок времени работой только тех клеток, которые находятся в зоне облучения (рис. 279). При этом часть клеток в зоне облучения осуществляет фотосинтез на линейном участке, а часть - на плато световой кривой фотосинтеза отдельной клетки. Остальные клетки (вне "зоны фотосинтеза") в принципе являются балластными и не дают вклад в общий фотосинтез популяции, поскольку длительность световых реакций фотосинтеза порядка 10-3 сек существенно короче периода миграции клеток между просвечиваемыми и непросвечиваемыми зонами суспензии, что достигается за счет перемешивания культуры.
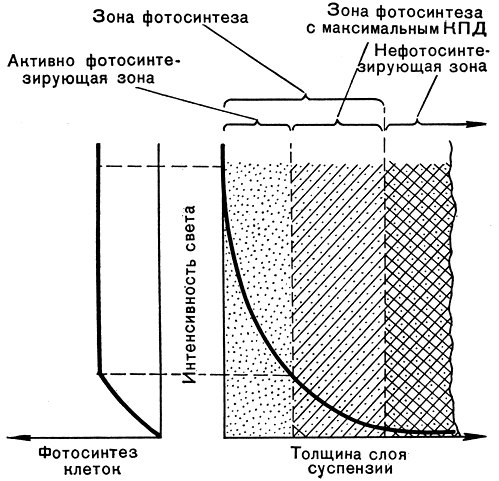
Рис. 279. Оптическая и функциональная структура культуры водорослей как фотосинтезирующей системы: справа - распределение света, слева - интенсивность фотосинтеза отдельной клетки в популяции микроводорослей
Описанные закономерности положены в основу ряда разработанных в настоящее время математических моделей фотосинтетической продуктивности микроводорослей и используются при конструкторской разработке технологии, реакторов и управляющей аппаратуры для высокоинтенсивного культивирования этих организмов.
Углекислота может вводиться в автотрофно выращиваемые культуры водорослей различными методами. Наиболее распространенный способ - это подача углекислоты в виде газовоздушной смеси, осуществляющей, помимо снабжения водорослей источником углерода, функцию перемешивания культуры. Найденные применительно к условиям высокоинтенсивного культивирования хлореллы насыщающие и полунасыщающие концентрации СO2 (рис. 280) оказались более высокими, чем описаны в литературе для разбавленных суспензий, но не превышающими значений 1,6-1,7% СO2 в газовой фазе (35-40⋅10-5 моля растворенной СO2 на 1 л) при насыщающих интенсивностях света и плотности суспензии 600 млн. клеток в 1 мл. На рисунке 280, A в виде трехмерного графика представлены семейства углекислотных и световых кривых фотосин-теза хлореллы и зависимость фотосинтетической продуктивности культуры от взаимосвязи этих характеристик. Так, при наибольшей, насыщающей интенсивности света продуктивность культуры в 4 раза выше при концентрации 1% СO2, чем при 0,25% СO2, и обратно: при одной и той же концентрации СO2 (например, 1% СO2) продуктивность тем выше, чем выше интенсивность света.
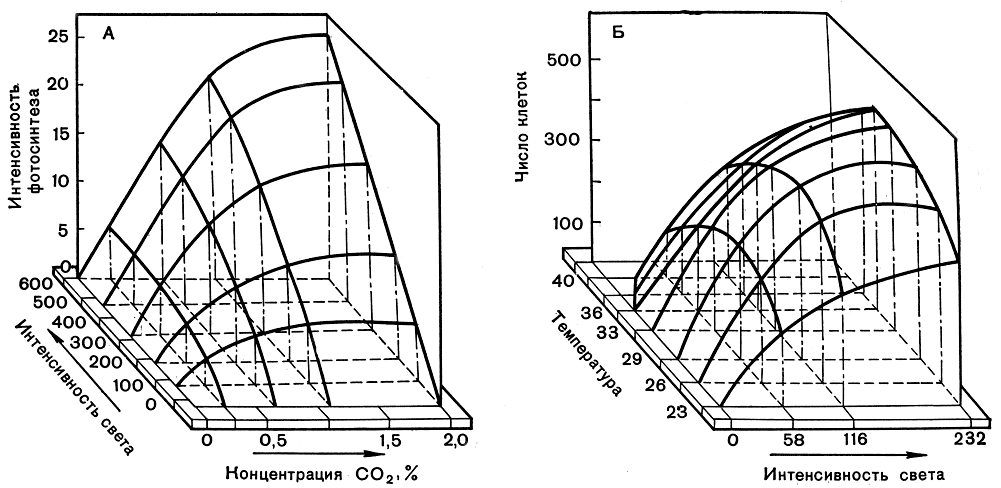
Рис. 280. Зависимость интенсивности фотосинтеза (A) и скорости роста (Б) культуры хлореллы от интенсивности света, концентрации углекислоты, температуры и от сопряженного их влияния (интенсивность света - в тыс. эрг/см2 в сек, интенсивность фотосинтеза - в л O2 с 1 л суспензии в сутки, число клеток - в млн. на 1 мл суспензии)
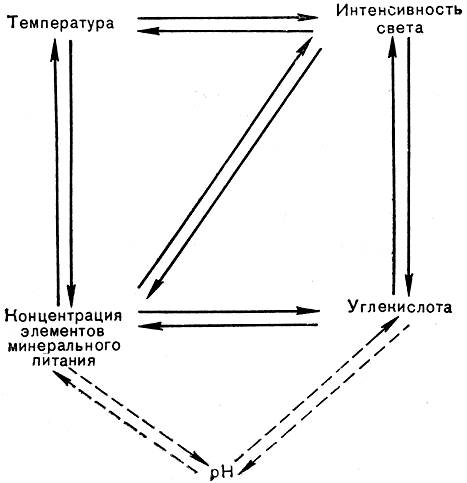
Схема взаимосвязи факторов, влияющих на продуктивность культуры
Водоросли различаются по световым и температурным оптимумам для роста и фотосинтеза.
В пределах рода Chlorella есть светолюбивые и теневыносливые культуры с меньшим или большим содержанием хлорофилла, с большей или меньшей активностью единицы хлорофилла, есть термофильные, мезофильные и психрофильные (хорошо растущие при температуре + 5... +10 °С) штаммы. Каждый штамм в той или иной мере обладает адаптационными способностями. Но у каждой культуры свой генетически закрепленный диапазон требований к освещенности и температуре.
На основании известных экспериментальных данных можно охарактеризовать в целом группу мезофильных культур как более тенелюбивую, а термофильных культур как более светолюбивую. Так, мезофильные формы обладают более низким и более узким плато светового насыщения для роста по сравнению с термофильными культурами.
Применение культур высоких плотностей имеет особенно большой смысл при высоких освещенностях, позволяющих максимально приблизиться к потенциально возможным скоростям роста культуры. На рисунке 280, Б приведены световые и температурные кривые зависимости роста термофильной культуры. Трехмерный график хорошо показывает тесную функциональную взаимообусловленность характера температурных и световых кривых роста и необходимость тщательного подбора оптимальных сочетаний этих параметров для высокопродуктивного культивирования. Для каждой интенсивности света существует своя температурная кривая роста и продуктивности культуры, так же как для каждой температуры имеется своя световая кривая. По мере повышения освещенности температурный оптимум смещается в сторону более высоких значений температуры, так же как и при повышении температуры для получения максимальной продуктивности необходимо соответствующее изменение освещенности. Важно, что в культурах высоких плотностей, как и в разбавленных суспензиях, четко обнаруживается эффект фотоингибирования роста (угнетение ростовых процессов под действием света) культуры при температуре, не сочетающейся с примененной интенсивностью света.
Если учесть, что температурные условия являются диффузно (или равномерно) действующим фактором и не зависят от плотности культуры, а облученность отдельных клеток в популяции, наоборот, сильно зависит от плотности и оптических свойств суспензии, то становится ясно: чтобы найти оптимальные сочетания облученности и температуры для каждой культуры, необходимо снять световые и температурные характеристики не только для клетки, но и для популяции.
Как показано на примерах влияния света, температуры, концентрации СO2, для получения высокой продуктивности культуры существенное значение имеет не столько зависимость роста и фотосинтеза водорослей от каждого из этих факторов в отдельности, сколько их сопряженное действие. Обнаруженные взаимосвязи могут быть показаны в виде схемы.
Поскольку в культурах высоких плотностей для обеспечения интенсивного роста применяют высокие освещенности, высокие температуры и высокие концентрации солей, т. е. создается напряженность всех факторов среды, "отставание" какого-либо одного фактора, нарушая сбалансированное взаимодействие всех факторов, может повлечь за собой не только снижение продуктивности до уровня действия этого минимального фактора, но во многих случаях и гибель культуры.
При создании систем культивирования водорослей высокой фотосинтетической производительности одним из первых встает вопрос о применении культур, генотипические свойства которых отвечали бы заданным условиям. Например, водоросли в интенсивно растущих плотных популяциях должны переносить кратковременную переоблученность, т. е. культура должна иметь высокое и продолженное плато светового насыщения для роста и фотосинтеза. Этим свойством в большей степени обладают термофильные штаммы.
При массовом культивировании под открытым небом более эффективными в определенные периоды могут быть мезофильные культуры. Японские исследователи провели выращивание смешанной культуры водорослей, состоящей из мезофильного и термофильного штаммов. В жаркие месяцы преимущественно развивалась термофильная форма, в остальное время - мезофильная.
Отбором в природе и селекционно-генетическими методами получено значительное число мезофильных и термофильных высокопродук-тивных форм хлореллы. Сравнительное изучение различных штаммов водорослей показывает широкое их разнообразие в отношении к температуре, освещенности, способности роста в плотных популяциях. Это открывает возможность направленного подбора форм водорослей применительно к конкретным условиям и целям их культивирования.
Отбор и поддержание в коллекции перспективных форм является важной задачей.
Развитие исследований по массовой культуре водорослей дало толчок к совершенствованию методов лабораторного их выращивания, благодаря чему возник метод лабораторного интенсивного культивирования микроводорослей. На рисунке 281 представлен один из способов современного лабораторного культивирования одноклеточных водорослей, обеспечивающий интенсивный рост культур, относящихся к различным систематическим группам (зеленые - Chlorella, Scenedesmus, Ankistrodesmus, Dunaliella, Chlamydomonas; сине-зеленые - Anacystis, Spirulina, Anabaena, Synechocystis, Aphanizomenon, Nostoc, Tolypothrix и др.).

Рис. 281. Лабораторная установка для выращивания в условиях интенсивного размножения и фотосинтеза различных культур одноклеточных микроскопических водорослей
Методы массового культивирования микроскопических водорослей
Массовая культура под открытым небом. Различного типа установки под открытым небом были испытаны и описаны уже в начале 50-х годов Институтом Карнеги (США), в Японии и некоторых других странах. В настоящее время существует много разных конструкций установок для выращивания водорослей под открытым небом (табл. 40, 41).

Таблица. 40. Комплекс Установок для массового полупроизводственного культивирования одноклеточных водорослей

Таблица 41. Комбинированная установка для массового культивирования водорослей, размещенная на крыше оранжереи (Чехословакия)
Принципиальная схема такого культивирования состоит в выращивании водорослей в жидких питательных средах в бассейнах, лотках и других емкостях с различными способами перемешивания, подачи углекислоты и использованием солнечного света.
Представляет интерес установка для массового культивирования сценедесмуса в Тжебоне (Чехословакия), где суспензия водорослей стекает по плоской, специальным образом оборудованной поверхности, которая является крышей оранжереи. В другом варианте эта же установка может размещаться на поверхности грунта и используется, в частности, в Болгарии.
В Рупите (Болгария) при строительстве установок массового культивирования применены местные природные ресурсы, обеспечивающие наряду с хорошей инсоляцией использование природного источника С02, воды источника, богатого минеральными солями, и регулирование температуры за счет воды горячих источни-ков. В Советском Союзе Биологическим институтом ЛГУ разработаны типовые установки лоткового типа с открытой циркуляционной системой. В Узбекистане используют преимущественно круглые бассейны по типу японских установок. Размеры установок варьируют от небольших до 1000-2000 м2.
В качестве объектов культивирования широко используются зеленые одноклеточные водоросли, особенно из протококковых (хлорелла и сценедесмус) и из вольвоксовых (дюналиелла); ведутся также работы с сине-зеленой нитчатой водорослью спирулиной и некоторыми другими.
Производительность установок составляет в среднем 15-20 г/м2, сухой биомассы в сутки, достигая иногда 25-30, а в отдельных случаях 35-40 г/м2. Урожай с единицы объема суспензии в условиях массовой культуры под открытым небом составляет в среднем 0,2 г/л в сутки, поднимаясь в отдельных случаях до 1,2 г/л. Плотность культуры, при которой ведется выращивание водорослей, варьирует в зависимости от типа установок и составляет 25-400 млн. клеток на 1 мл.
Культуры под открытым небом характеризуются низкими коэффициентами размножения, что свидетельствует, по существу, об экстенсивном ведении культуры, при котором получение больших количеств биомассы обеспечивается использованием больших площадей.
Постоянно меняющиеся погодные условия являются причиной того, что в установках открытого типа невозможно длительное, стабильное снятие устойчивого урожая, что приближает этот принцип культивирования водорослей к способам возделывания высших растений, когда процесс накопления урожая существенным образом зависит от погодных условий.
Продуктивность установок под открытым небом удается повысить путем организации систем обогрева и охлаждения и досвечивания культуры искусственными источниками освещения. Такое культивирование, по существу, занимает промежуточное положение между экстенсивной культурой водорослей и интенсивным высокоорганизованным культивированием по типу микробиологических производств.
Интенсивная культура. В 60-х годах в различных лабораториях был разработан ряд установок и аппаратов высокоинтенсивного управляемого культивирования фотосинтезирующих микроводорослей в полностью контролируемых условиях с автоматической стабилизацией оптимальных условий и непрерывной автоматической регистрацией таких важных физиологических функций культуры, как скорость роста, интенсивность фотосинтеза, минеральное питание.
Наиболее совершенным из таких методов культивирования является проточное выращивание водорослей, при котором по сигналам, получаемым от самой культуры, осуществляются автоматический отбор прирастающих клеток (урожая), подача свежей питательной среды и стабилизация оптической плотности культуры. Одна из принципиальных схем такого типа культивирования представлена на рисунке 282.
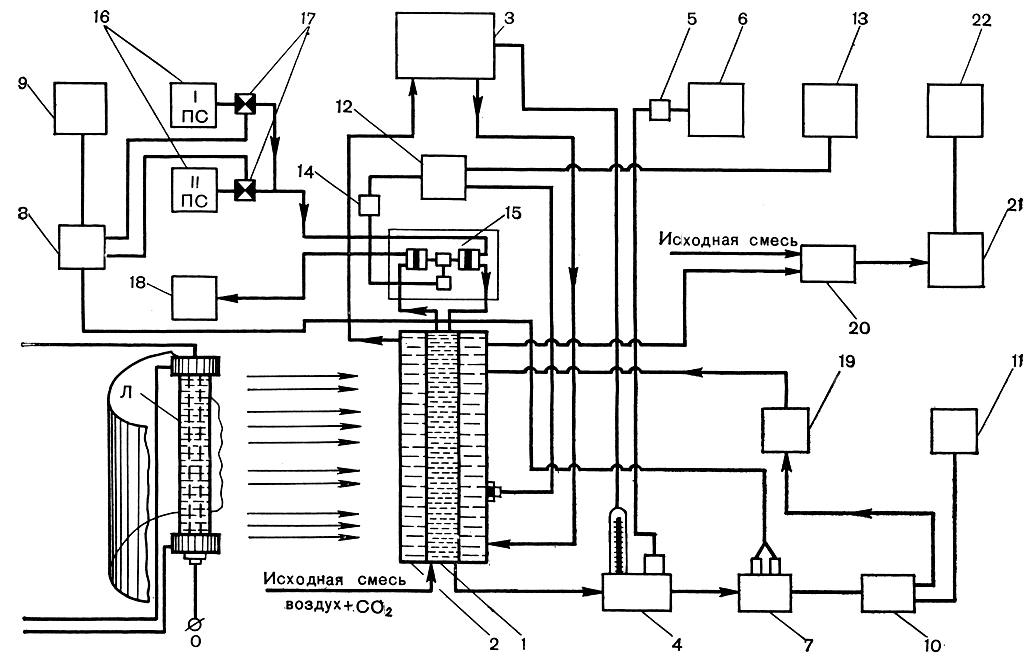
Рис. 282. Принципиальная схема высокоинтенсивного управляемого проточного культивирования микроводорослей в контролируемых условиях: 1 - реактор; 2 - рубашка водяного охлаждения; 3 - ультратермостат; 4 - блок термодатчиков; 5 - схема записи температуры; 6 - прибор, регистрирующий температуру; 7-9 - схема контроля и регистрации рН; 10 - датчик плотности; 11-14 - система контроля, регистрации и регулировки плотности; 15 - дозирующее устройство; 16 - основная и корректирующие питательные среды; 17 - исполнительные электромагнитные клапаны, управляемые системой регулировки рН; 18 - сборник урожая; 19 - циркуляционная помпа; 20 - командное электропневматическое устройство; 21 - газоанализатор СO2; 22 - прибор, регистрирующий газовый состав; Л - источник света
Главным преимуществом этих методов культивирования является возможность вести длительное непрерывное выращивание водорослей с поддержанием постоянной плотности суспензии на оптимальных значениях, при которых наблюдается максимальная продуктивность культуры. С этой целью разработаны специальные реакторы, в которых используются мощные источники света и специальные системы светораспределения и световодов, что обеспечивает равномерное освещение клеток в достаточно плотных культурах. Примеры таких установок даны на таблице 40 и рисунке 283.

Рис. 283. Установки для высокоинтенсивного проточного культивирования водорослей: вверху - реактор с системой световодов, внизу - плоскопараллельный реактор барботажнокамерного типа
Урожаи, в частности, хлореллы, которые получают в таких установках, составляют примерно 30-40 г сухой биомассы с 1 л суспензии в сутки или 80-100 г с 1 м2 освещаемой поверхности.
Таким образом, в настоящее время можно считать достаточно детально разработанными физиологические основы культивирования микроскопических фотосинтезирующих водорослей и некоторые принципы технологии их выращивания как в установках под открытым небом, так и в закрытых аппаратах.
Рентабельность массового культивирования водорослей существенным образом зависит от аспектов применения получаемой биомассы и должна оцениваться, очевидно, в каждом конкретном случае индивидуально. Так, методы высокоинтенсивного культивирования водорослей, помимо исследовательской работы, направленной на выяснение потенциальной продуктивности фотосинтетического аппарата растений и других проблем физиологии, биохимии и генетики фотосинтезирующих клеток, находят применение для биосинтеза соединений, меченых различными изотопами углерода (С14, С13), дейтерированных соединений, а также в космической биологии для создания замкнутых экологических систем жизнеобеспечения. Высокая продуктивность и стабильность работы систем интенсивного проточного культивирования хлореллы позволили осуществить многомесячные эксперименты с испытателями по биологической регенерации воздуха с помощью фотосинтеза.
Эффективность применения биомассы водорослей в сельском хозяйстве остается еще неясной. Биомасса водорослей, получаемая при культивировании под открытым небом, используется для изучения их кормовых достоинств как источника белка и физиологически активных соединений. Результаты противоречивы, что свидетельствует о необходимости проведения дальнейшей исследовательской работы.
Вместе с тем в более широком плане разработка способов промышленного культивирования одноклеточных фотосинтезирующих микроводорослей является одним из путей введения процесса фотосинтеза в промышленное производство. Последствия такого явления своеобразной индустриализации фотосинтеза трудно переоценить.
|
|
© PLANTLIFE.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://plantlife.ru/ 'PlantLife.ru: Статьи и книги о растениях'